| Punti salienti |
• Lo spettro delle implicazioni cliniche del complesso ventricolare prematuro (PVC) è ampio e va dall’essere completamente benigno allo sviluppo di cardiomiopatia e insufficienza cardiaca e può essere associato ad un aumento del rischio di morte improvvisa. • I PVC possono essere sia una causa che una conseguenza di cardiomiopatia non diagnosticata e progressione dell’insufficienza cardiaca congestizia. • Nei pazienti con un elevato carico di PVC (>10%), l’elettrocardiogramma, l’ecografia, il monitoraggio Holter e l’ecocardiografia sono fondamentali nella valutazione delle caratteristiche che aiutano a guidare le future decisioni gestionali. • La gestione delle PVC sintomatiche, delle PVC ad alto rischio di morte cardiaca improvvisa o di un carico elevato di PVC che causano cardiomiopatia comprende la terapia medica e l’ablazione transcatetere. |
I complessi ventricolari prematuri (PVC) sono definiti dall’attivazione elettrica precoce da una regione focale del ventricolo, che porta alla contrazione ventricolare prima della coordinazione e dell’adeguato riempimento di queste camere.
Il significato clinico dei PVC varia dall’essere completamente benigno a pericoloso per la vita.
Una percentuale significativa di pazienti presenta PVC praticamente senza significato clinico; Tuttavia, esiste un numero considerevole di pazienti in cui le PVC possono rappresentare una cardiomiopatia sottostante o una predisposizione allo sviluppo di insufficienza cardiaca. Alcuni PVC possono anche aumentare il rischio di aritmie ventricolari, sincope e morte cardiaca improvvisa.
I fattori di rischio includono l’età avanzata, il sesso maschile, il fumo e l’obesità. Data la sua frequenza nella pratica clinica, è imperativo che il medico di base abbia conoscenza del meccanismo fisiopatologico, degli studi necessari e del trattamento delle PVC. Inoltre, il medico di base deve essere in grado di distinguere le PVC benigne da quelle maligne e sapere quando richiedere la consulenza di un esperto.
| Fisiopatologia |
Per spiegare la generazione del PVC vengono utilizzati tre meccanismi principali: attività innescata, automatismo potenziato e rientro.
L’attività innescata è mediata da un aumento della concentrazione di calcio intracellulare, con conseguente postdepolarizzazione ritardata o depolarizzazione anomala dei miociti cardiaci dopo la normale depolarizzazione.
L’automatismo potenziato si verifica quando alcuni tessuti miocardici mostrano una generazione automatica potenziata o esagerata di impulsi elettrici cardiaci. Il rientro come meccanismo richiede 2 percorsi elettrici separati e distinti con conduzione differenziale a ciascuna estremità. Regioni cicatrizzate e fibrotiche (ad esempio, derivanti da malattia coronarica, cardiomiopatie) possono far sì che i PVC abbiano un meccanismo di rientro ( Figura 1 ).
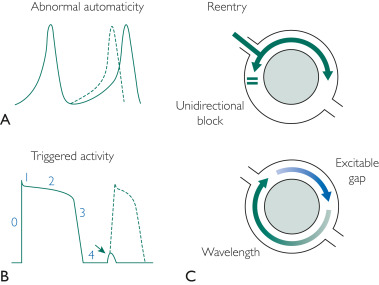
FIGURA 1 . Tre meccanismi di aritmogenesi prematura del complesso ventricolare. A, automatismo anormale: notare l’inizio precoce del potenziale d’azione (linea tratteggiata). B, Attività innescata: notare il ritardo nella postdepolarizzazione che si verifica nella fase 4 del potenziale d’azione cardiaco. Se questa raggiunge la soglia, può verificarsi una depolarizzazione completa (linea tratteggiata). Questo è solo un esempio del meccanismo di attività innescata. C, Rientro: barriera di conduzione (cerchio grigio, che rappresenta la fibrosi o barriera funzionale) con blocco unidirezionale che produce un’aritmia di rientro.
| Tempi elettrici e cambiamenti emodinamici associati |
Un PVC interrompe il normale riempimento dei ventricoli. Oltre al fatto che il complesso QRS (che rappresenta la contrazione ventricolare) si verifica prima del previsto, i PVC hanno generalmente un aspetto QRS più ampio (durata più lunga) sull’ECG rispetto a un tipico complesso QRS osservato nel ritmo sinusale ( Figura 2 ).
I complessi ventricolari prematuri hanno origine da impulsi elettrici focali provenienti da diversi siti dei ventricoli. A differenza di un ritmo normale, la conduzione elettrica con una CVP generalmente non utilizza il sistema di conduzione specializzato.
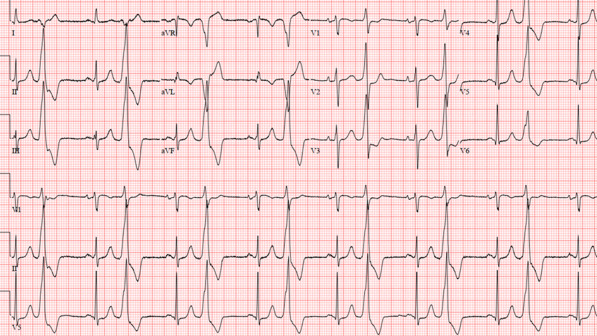
FIGURA 2. Complessi ventricolari prematuri con pattern bigemino. Notare i battiti ampi e complessi che si verificano ogni due battiti sinusali (QRS stretto, preceduto dall’onda p). Queste contrazioni ventricolari premature hanno un asse inferiore prominente (II, III e aVF positivi e aVR e aVL negativi), che probabilmente indicano un’origine del tratto di efflusso.
Poiché il riempimento diastolico del ventricolo viene interrotto, ciò si traduce in una riduzione del riempimento ventricolare. Pertanto, la gittata cardiaca derivante dalla contrazione ventricolare correlata alla PVC diminuisce. Può causare ai pazienti una serie di sintomi, tra cui mancanza di respiro, vertigini e affaticamento. Inoltre, la pressione atriale sinistra può essere significativamente elevata, causando dispnea a causa delle pressioni polmonari più elevate.
| Valutazione clinica e storia naturale della CVP |
La presentazione clinica dei PVC può essere variata. La maggioranza, in particolare quelli con carico basso, sono asintomatici in una percentuale compresa tra il 50 e il 75% dei pazienti. Per coloro in cui si manifestano i sintomi, le manifestazioni più comuni includono extrasistoli, palpitazioni e battito cardiaco prominente con sensazione di martellamento.
Nel caso di PVC più frequenti ed emodinamicamente significative, i pazienti possono lamentare affaticamento, vertigini, presincope e sintomi di insufficienza cardiaca, come dispnea, ortopnea ed edema.
In casi estremi, i pazienti con PVC elettrofisiologicamente significative possono presentare sincope e arresto cardiaco improvviso.
In questo contesto, deve essere ottenuta un’attenta anamnesi clinica per differenziare le cause della sincope. La sincope vasovagale (riflesso), che fa presagire un decorso clinico più benigno, di solito si presenta con un fattore o evento precipitante (p. es., disidratazione) e sintomi precedenti (p. es., nausea, diaforesi). La sincope cardiogena o aritmogena appare improvvisamente e senza preavviso e può essere associata allo sforzo.
L’anamnesi familiare dovrebbe includere lo screening per insufficienza cardiaca, malattia coronarica, aritmie, storia di cardiomiopatia e morti improvvise e inspiegabili, soprattutto nei giovani membri della famiglia. La storia sociale dovrebbe includere una descrizione dettagliata dell’assunzione di caffeina, dell’uso di alcol, di integratori, dell’uso di droghe e dei fattori di stress psicologico. Dovrebbero essere valutate anche attività come l’esercizio fisico e la partecipazione sportiva.
I farmaci che possono innescare la CVP includono beta-agonisti (come gli inalatori di salbutamolo per l’asma o la malattia polmonare ostruttiva cronica), alcol, caffeina e stimolanti come quelli derivati dalle anfetamine. L’auscultazione cardiaca è essenziale. I segni clinici di insufficienza cardiaca dovrebbero essere valutati e valutati.
Vengono monitorati l’anamnesi del paziente, la morfologia della PVC (che consente la localizzazione della sua origine nel cuore), gli intervalli di accoppiamento della PVC (la durata tra la fine del QRS precedente e l’inizio della PVC) e il carico pressorio. La CVP per 24 ore è essenziale per determinare la gestione adeguata.
Alcuni pazienti possono avere un carico CVP basso ma avere conseguenze gravi (come morte cardiaca improvvisa) se l’intervallo di accoppiamento è inferiore a 300 millisecondi. Pertanto, deve esserci sempre un elevato livello di sorveglianza per garantire una valutazione adeguata ( Figura 3 ).
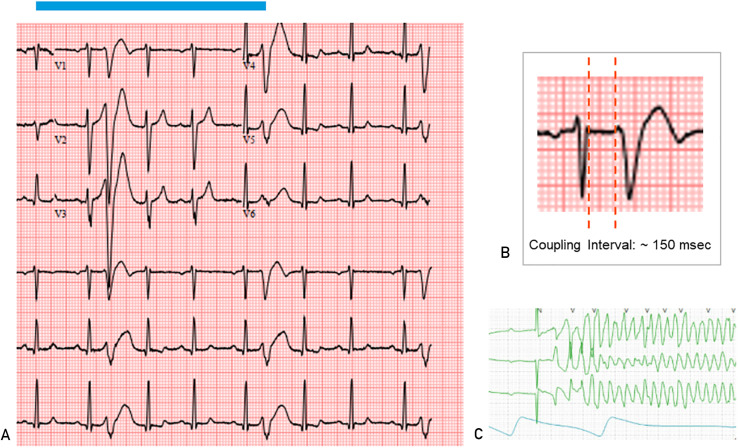
FIGURA 3 . A, Elettrocardiogramma che mostra un complesso ventricolare prematuro ad accoppiamento corto (CVP). Si noti che queste PVC ad accoppiamento corto cadono sull’onda T del battito sinusale precedente. B, la misurazione dell’intervallo di accoppiamento del PVC deve essere effettuata alla fine del QRS anteriore e all’inizio del PVC. C, Striscia telemetrica che mostra una tachicardia ventricolare polimorfica innescata da un PVC strettamente accoppiato nello stesso paziente.
Nello specifico, l’internista dovrebbe concentrarsi sulle seguenti caratteristiche per rivolgersi a un cardiologo: sintomi della PVC, sospetta sincope cardiaca, storia familiare di morte improvvisa, carico di PVC superiore al 10% e PVC ad accoppiamento corto (intervallo di accoppiamento <300 millisecondi). ).
| Strategia di test diagnostici su misura per CVP |
Nel contesto delle cure primarie, la profondità dei test diagnostici dovrebbe essere attentamente adattata al sospetto clinico dopo che è stata ottenuta l’anamnesi medica ed è stato eseguito l’esame fisico. In quasi tutti i pazienti sani e asintomatici senza malattia cardiaca nota o sospetta, l’ECG iniziale è ragionevole. Se i sintomi sono presenti, o l’esame o l’elettrocardiogramma rivelano preoccupazione per un aumento del carico della CVP (>1 su 10 battiti), deve essere eseguito il monitoraggio Holter per una valutazione delle 24 ore.
> Elettrocardiografia e monitoraggio Holter
Nel monitoraggio ECG e Holter, il medico deve considerare quanto segue: carico di PVC (solitamente presentato come percentuale su un periodo di tempo); Morfologia e asse del PVC per aiutare a localizzare il sito di origine; Intervallo di accoppiamento CVP; e, soprattutto, se il paziente presenta sintomi, correlazione dei PVC nel momento esatto in cui si manifestano i sintomi.
> Ecocardiografia transtoracica
L’ecocardiografia transtoracica deve essere presa in considerazione nei pazienti con un carico di PVC superiore al 5% o se clinicamente indicato dall’anamnesi e dall’esame obiettivo. In particolare, i medici dovrebbero cercare una ridotta funzione sistolica ventricolare sinistra (frazione di eiezione ventricolare sinistra <50%) o segni di allargamento e disfunzione ventricolare sinistra o destra, soprattutto se sono maggiori di lievi.
Dovrebbero essere prese in considerazione anche le malattie valvolari , come il prolasso della valvola mitrale o la disgiunzione dell’anulus mitralico. Anomalie strutturali cardiache possono far presagire un ulteriore rischio aritmico o cardiomiopatico per i PVC originati in questa regione e dovrebbero pertanto essere indirizzate a un cardiologo, se presente.
> Test aggiuntivi
Ulteriori test dovrebbero essere guidati dall’anamnesi e dal sospetto clinico dopo che lo studio è stato ottenuto. Gli studi di laboratorio dovrebbero, come minimo, includere la valutazione dei valori degli elettroliti sierici , in particolare di potassio e magnesio. In generale, la concentrazione sierica di potassio deve essere mantenuta al di sopra di 4,0 mEq/L e la concentrazione sierica di magnesio deve essere mantenuta al di sopra di 2,0 mEq/L.
L’ormone stimolante la tiroide deve essere monitorato per escludere la malattia della tiroide come causa secondaria della PVC.
Il peptide natriuretico cerebrale può essere testato come possibile marcatore sierologico di anomalia strutturale cardiaca.
I test da sforzo , con e senza imaging cardiaco aggiuntivo (come l’ecocardiografia da sforzo o il test da sforzo di perfusione nucleare), possono essere presi in considerazione per escludere una cardiopatia ischemica se clinicamente indicato.
L’imaging cardiaco avanzato, come la risonanza magnetica cardiaca per valutare varie cardiomiopatie e la tomografia cardiaca ad emissione di positroni per valutare l’infiammazione attiva, come la sarcoidosi cardiaca, dovrebbe generalmente essere eseguita sotto la guida di specialisti in cardiologia. Questi test generalmente non vengono eseguiti di routine senza una consulenza cardiologica.
| Terapie per la CVP |
La maggior parte dei pazienti con PVC, soprattutto con carico basso, sono asintomatici e non necessitano di ulteriori studi, terapie o follow-up.
Il medico di base dovrebbe essere a proprio agio con i principi di base della gestione della PVC, compreso quando iniziare il trattamento, appropriati test di follow-up e quando rivolgersi per una consulenza cardiologica.
> Consulenza e gestione non farmacologica
È importante chiedere ai pazienti quanto siano fastidiosi i loro sintomi e se, dopo essere stati rassicurati, vorrebbero provare la terapia medica o l’ablazione transcatetere, considerati i potenziali rischi e gli effetti avversi in una condizione altrimenti benigna. Inoltre, sebbene non esistano studi definitivi che colleghino i PVC a queste abitudini di vita, moderare il consumo di caffeina e alcol, così come smettere di fumare, è un consiglio ragionevole.
In generale, gli autori raccomandano che tutti i pazienti facciano esercizio fisico per un minimo di 30 minuti al giorno per 5 giorni alla settimana. I pazienti sono spesso preoccupati per questo e dovrebbero essere rassicurati sul fatto che l’esercizio fisico è sicuro. Se si riscontra un chiaro peggioramento dei sintomi con l’esercizio fisico, dovrebbero essere presi in considerazione ulteriori studi, come i test da sforzo.
> Terapia medica
I pilastri del trattamento farmacologico sono i beta-bloccanti e i calcioantagonisti non diidropiridinici (diltiazem o verapamil). Da notare che alcuni pazienti non possono tollerare questi farmaci a causa di effetti avversi, come affaticamento, depressione e disfunzione erettile. In tali pazienti, se vi è un’alta frequenza di PVC, sintomi correlati alla PVC, insufficienza cardiaca indotta da PVC o aritmie, si dovrebbe cercare di rivolgersi tempestivamente a un elettrofisiologo cardiaco per prendere in considerazione l’ablazione transcatetere.
I beta -bloccanti e i calcio-antagonisti non diidropiridinici rappresentano trattamenti farmacologici di prima linea. Entrambi i farmaci sono stati associati a riduzioni clinicamente significative del carico di PVC in circa il 12%-24% dei pazienti in studi randomizzati e controllati, indicando l’efficacia piuttosto limitata del trattamento farmacologico.
Se i beta-bloccanti e i calcio-antagonisti sono inefficaci, si possono prendere in considerazione altri antiaritmici se il paziente è titubante riguardo all’ablazione transcatetere. Sotalolo (antiaritmico di classe III), flecainide ( antiaritmico di classe Ic) e propafenone (antiaritmico di classe Ic) possono essere ben tollerati ed efficaci. L’amiodarone è un farmaco molto efficace, ma può potenzialmente causare effetti avversi a lungo termine che ne limitano l’uso nei pazienti più giovani.
> Ablazione transcatetere
L’ablazione transcatetere è un metodo invasivo ma efficace per il trattamento dei PVC, con tassi di successo procedurale compresi tra l’80% e il 95%. Nelle più recenti dichiarazioni di consenso degli esperti, i farmaci e l’ablazione transcatetere possono essere considerati terapie di prima linea. Pertanto, la decisione di eseguire direttamente una procedura di ablazione transcatetere può essere discussa con i pazienti che esitano ad assumere farmaci a lungo termine o che in precedenza non hanno risposto ai farmaci a causa di effetti avversi e intolleranza.
| Direzioni future |
Nel prossimo futuro si può prevedere un miglioramento nel rilevamento del PVC mediante dispositivi indossabili.
Attualmente, una regola generale è che il medico debba sempre esaminare manualmente le strisce del ritmo per individuare le aritmie rilevate dal dispositivo per evitare una sovradiagnosi di artefatti che spesso accompagnano la pletismografia.
La tecnologia dovrebbe sempre rimanere un complemento, e non un sostituto, del giudizio clinico.
| Conclusione |
Poiché vengono identificati sempre più pazienti con PVC, è fondamentale che il medico di base abbia familiarità con i fondamenti della diagnosi e del trattamento. I PVC sono estremamente comuni nella popolazione generale e la maggior parte non richiede studi o trattamenti aggiuntivi, il cui riconoscimento evita ulteriori test non necessari.
I medici devono anche prestare attenzione alle PVC sintomatiche o alle caratteristiche ad alto rischio, tra cui un carico di PVC superiore al 10%, storia familiare di morte improvvisa, sincope cardiogena, PVC ad accoppiamento corto (intervallo di accoppiamento <300 millisecondi) e segni e sintomi di disturbi cardiaci. fallimento.
Si può tentare un trattamento farmacologico con beta-bloccanti o calcio-antagonisti ed è giustificato l’invio a un cardiologo o a un elettrofisiologo cardiaco per iniziare il trattamento con farmaci antiaritmici o l’ablazione transcatetere.
















