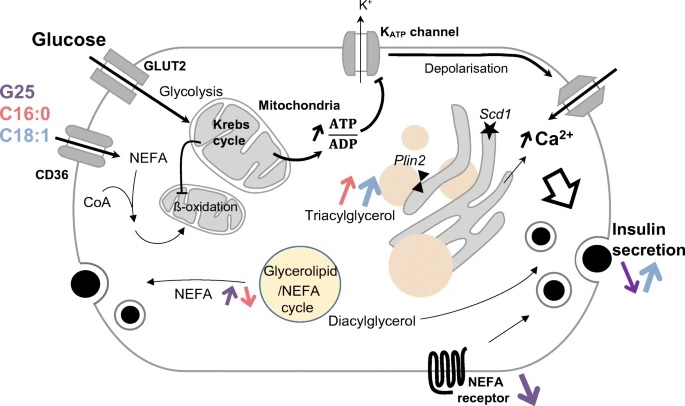
Zusammenfassung Ziele/Hypothesen Es wurde vermutet, dass eine chronische Exposition der Betazellen der Bauchspeicheldrüse gegenüber erhöhten Glukose- und Fettsäurenspiegeln eine Glukopotoxizität hervorruft . Widersprüchliche Ergebnisse deuten jedoch auf Anpassungen der Betazellen hin , die für die teilweise Erhaltung der sekretorischen Reaktion entscheidend sein könnten. In diesem Zusammenhang beschreiben wir das Expressionsmuster von Genen, die mit Lipidwegen sowie der Fettspeicherung/-mobilisierung während der glukosestimulierten Insulinsekretion zusammenhängen. Methoden Insulinsekretierende Zellen wurden 3 Tage lang bei verschiedenen Glukosekonzentrationen (5,5, 11,1, 25 mmol/L) ohne oder mit 0,4 mmol/L Palmitat und Oleat im Komplex mit BSA kultiviert. Anschließend wurden transkriptomische Analysen der Lipidwege in menschlichen Inseln mittels RNA-Seq und in INS-1E-Zellen und Ratteninseln mittels quantitativer RT-PCR durchgeführt. Die Fettspeicherung in INS-1E-Zellen wurde mittels Elektronenmikroskopie und Bodipy-Färbung beurteilt, die auch zur Messung der Lipidmobilisierungsrate verwendet wurde. Die sekretorische Reaktion wurde während der akuten Stimulation mit 15 mmol/l Glucose mithilfe eines Online-Lumineszenztests für INS-1E-Zellen und eines Radioimmunoassays für Ratteninseln überwacht. Ergebnisse Auf menschlichen Inseln veränderte die chronische Exposition gegenüber Palmitat und Oleat die Expression einer Reihe von Genen, die am Lipidmanagement beteiligt sind. Die Kultivierung bei 25 mmol/l Glukose führte zu hochregulierten Genen, die für Enzyme des Glycerolipid-/NEFA-Zyklus kodieren, und zu herunterregulierten Rezeptoren, die an der Signalübertragung von Fettsäuren beteiligt sind. Ähnliche Ergebnisse wurden in INS-1E-Zellen erhalten, was auf eine erhöhte Kapazität des Glycerolipid/NEFA-Zyklus unter glukotoxischen Bedingungen hinweist. Die Exposition gegenüber ungesättigten C18:1-Fettsäuren förderte die Akkumulation intrazellulärer Lipide in glukoseabhängiger Weise , ein Effekt, der auch bei gesättigten C16:0-Fettsäuren in Kombination mit dem Panlipase-Inhibitor Orlistat beobachtet wurde. Nach einer glukopotoxischen Kultur war eine intrazelluläre Fettmobilisierung für eine akute glukosestimulierte Sekretion erforderlich, insbesondere in Zellen, die unter glukotoxischen Kulturbedingungen mit Oleat behandelt wurden. Die Geschwindigkeit der Lipidmobilisierung wurde hauptsächlich durch die Menge an gespeichertem Fett als direkte Folge der Kulturbedingungen und nicht durch den Energiebedarf bestimmt, außer in mit Palmitat beladenen Zellen. Schlussfolgerungen/Interpretation Glykolipotoxische Bedingungen fördern die Kapazität des Glycerolipid/NEFA-Zyklus und bewahren so einen Teil der sekretorischen Reaktion. Der Fettspeicherungs-/Mobilisierungszyklus erweist sich als ein Mechanismus, der der Betazelle hilft , mit glukotoxischen Bedingungen umzugehen. |
Kommentare
Die unerwarteten Vorteile von Fett bei Typ-2-Diabetes
Wissenschaftler der UNIGE haben herausgefunden, dass Fett der Bauchspeicheldrüse dabei helfen kann, sich an überschüssigen Zucker anzupassen und so die Entstehung von Diabetes verlangsamen kann.
Da fast 10 % der Weltbevölkerung betroffen sind, ist Typ-2-Diabetes ein großes Problem für die öffentliche Gesundheit. Ein übermäßig sitzender Lebensstil und eine kalorienreiche Ernährung begünstigen die Entstehung dieser Stoffwechselerkrankung, indem sie die Funktion der Bauchspeicheldrüsenzellen verändern und die Blutzuckerregulierung weniger effektiv machen.
Allerdings könnte Fett , das oft als idealer Übeltäter genannt wird, rehabilitiert werden. Tatsächlich verschlimmert Fett die Krankheit nicht unbedingt und könnte sogar eine schützende Rolle spielen: Durch die Untersuchung insulinproduzierender Betazellen der Bauchspeicheldrüse zeigten Wissenschaftler der Universität Genf (UNIGE), Schweiz, dass diese Zellen weniger unter überschüssigem Fett leiden. Zucker, wenn er zuvor Fett ausgesetzt war.
Durch die Untersuchung der zellulären Mechanismen entdeckten die Forscher, wie ein Zyklus aus Fettspeicherung und -mobilisierung es den Zellen ermöglicht, sich an überschüssigen Zucker anzupassen . Diese in der Fachzeitschrift Diabetologia veröffentlichten Ergebnisse verdeutlichen einen unerwarteten biologischen Mechanismus, der als Hebel zur Verzögerung des Ausbruchs von Typ-2-Diabetes genutzt werden könnte.
Typ-2-Diabetes entsteht durch eine Funktionsstörung der Betazellen der Bauchspeicheldrüse, die für die Insulinsekretion verantwortlich sind. Dies beeinträchtigt die Regulierung des Blutzuckerspiegels und kann zu schwerwiegenden Komplikationen an Herz, Augen und Nieren führen.
In den 1970er Jahren rückte Fett in den Fokus und es entstand das Konzept der Lipotoxizität : Die Einwirkung von Fett auf Betazellen würde zu deren Schädigung führen. In jüngerer Zeit wird auch zu viel Zucker für die Schädigung der Betazellen und die Förderung der Entstehung von Typ-2-Diabetes verantwortlich gemacht.
Obwohl jedoch kein Zweifel mehr an der Schuld des Zuckers besteht, bleibt die Rolle von Fett bei der Funktionsstörung der Betazellen unklar. Welche zellulären Mechanismen sind beteiligt?
„Um diese Schlüsselfrage zu beantworten, haben wir untersucht, wie sich Betazellen von Menschen und Mäusen an einen Überschuss an Zucker und/oder Fett anpassen“, erklärt Pierre Maechler, Professor an der Abteilung für Zellphysiologie und Stoffwechsel und am Diabeteszentrum der UNIGE-Fakultät. of Medicine, der diese Arbeit leitete.
Wenn Fett den Betazellen zur Seite steht
Um die Wirkung von Fett von der von Zucker zu unterscheiden, setzten Wissenschaftler Betazellen überschüssigem Zucker, überschüssigem Fett und dann einer Kombination aus beidem aus. Zum ersten Mal wurde eine Zuckertoxizität bestätigt: Betazellen, die hohen Zuckermengen ausgesetzt waren, schütteten viel weniger Insulin aus als normal.
„Wenn Zellen sowohl zu viel Zucker als auch zu viel Fett ausgesetzt sind, speichern sie Fett in Form von Tröpfchen in Erwartung weniger erfolgreicher Zeiten“, erklärt Lucie Oberhauser, Forscherin in der Abteilung für Zellphysiologie und Stoffwechsel der medizinischen Fakultät der UNIGE , und Erstautor dieser Arbeit.
| „Überraschenderweise haben wir gezeigt, dass dieser Fettvorrat die Situation nicht verschlimmert, sondern eine Wiederherstellung der Insulinsekretion auf ein nahezu normales Niveau ermöglicht .“ Die Anpassung der Betazellen an bestimmte Fette würde somit zur Aufrechterhaltung eines normalen Blutzuckerspiegels beitragen.“ |
Die wesentliche adaptive Verwendung von Fett
Durch die weitere Analyse der zellulären Veränderungen erkannte das Forschungsteam, dass es sich bei den Fetttröpfchen nicht um statische Reserven handelte, sondern um den Ort eines dynamischen Zyklus der Speicherung und Mobilisierung.
Und dank dieser freigesetzten Fettmoleküle passen sich Betazellen an überschüssigen Zucker an und sorgen für eine nahezu normale Insulinsekretion. „Solange der Körper es als Energiequelle nutzt, stellt diese Fettfreisetzung kein wirkliches Problem dar“, ergänzt Pierre Maechler.
„Um eine Diabetes-Erkrankung zu vermeiden, ist es wichtig, diesem wohltuenden Kreislauf die Möglichkeit zu geben, aktiv zu sein, beispielsweise durch regelmäßige körperliche Aktivität.“
Wissenschaftler versuchen nun, den Mechanismus zu bestimmen, durch den dieses freigesetzte Fett die Insulinsekretion stimuliert , in der Hoffnung, einen Weg zu finden, den Ausbruch von Diabetes zu verzögern.