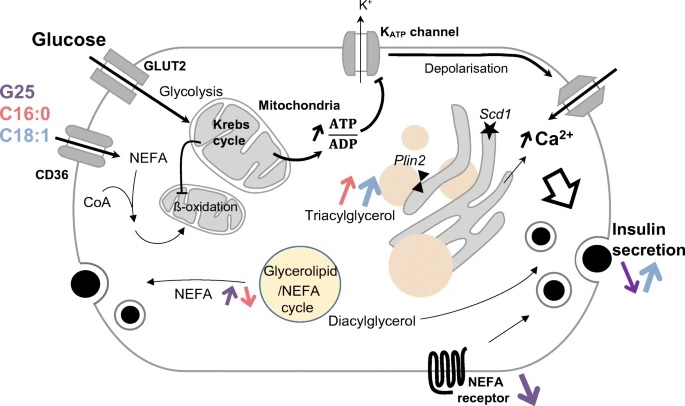
Riepilogo Obiettivi/ipotesi È stato proposto che l’esposizione cronica delle cellule beta pancreatiche a livelli elevati di glucosio e acidi grassi induca glucolipotossicità . Tuttavia, risultati contrastanti suggeriscono adattamenti delle cellule beta, che potrebbero essere fondamentali per la parziale conservazione della risposta secretoria. In questo contesto, delineiamo il modello di espressione dei geni correlati alle vie lipidiche insieme all’accumulo/mobilizzazione del grasso durante la secrezione di insulina stimolata dal glucosio. Metodi Le cellule secernenti insulina sono state coltivate per 3 giorni a diverse concentrazioni di glucosio (5,5, 11,1, 25 mmol/L) senza o con 0,4 mmol/L di palmitato e oleato in complesso con BSA. Le analisi trascrittomiche delle vie lipidiche sono state quindi eseguite nelle isole umane mediante RNA-Seq e nelle cellule INS-1E e nelle isole di ratto mediante RT-PCR quantitativa. L’accumulo di grasso è stato valutato nelle cellule INS-1E mediante microscopia elettronica e colorazione Bodipy, utilizzata anche per misurare il tasso di mobilizzazione dei lipidi. La risposta secretoria è stata monitorata durante la stimolazione acuta con 15 mmol/l di glucosio utilizzando un test di luminescenza in linea per le cellule INS-1E e mediante test radioimmunologici per le isole di ratto. Risultati Nelle isole umane, l’esposizione cronica al palmitato e all’oleato ha modificato l’espressione di un gruppo di geni coinvolti nella gestione dei lipidi. La coltivazione a 25 mmol/L di glucosio ha sovraregolato i geni che codificano per gli enzimi del ciclo glicerolipidico/NEFA e ha sottoregolato i recettori coinvolti nella segnalazione degli acidi grassi. Risultati simili sono stati ottenuti nelle cellule INS-1E, indicando una maggiore capacità del ciclo glicerolipide/NEFA in condizioni glucotossiche . L’esposizione agli acidi grassi insaturi C18:1 ha promosso l’accumulo di lipidi intracellulari in modo glucosio-dipendente , un effetto che è stato osservato anche con gli acidi grassi saturi C16:0 quando combinati con l’inibitore della panlipasi Orlistat. Dopo la coltura glucotossica, la mobilizzazione del grasso intracellulare era necessaria per la secrezione acuta stimolata dal glucosio, in particolare nelle cellule trattate con oleato in condizioni di coltura glucotossica. Il tasso di mobilizzazione dei lipidi è stato determinato principalmente dai livelli di grasso immagazzinato come diretta conseguenza delle condizioni di coltura piuttosto che dalle richieste energetiche, tranne che nelle cellule caricate con palmitato. Conclusioni/interpretazione Le condizioni glicolipotossiche promuovono la capacità del ciclo glicerolipide/NEFA, preservando così parte della risposta secretoria. Il ciclo di stoccaggio/mobilizzazione del grasso emerge come un meccanismo che aiuta le cellule beta a far fronte alle condizioni glucotossiche. |
Commenti
I benefici inaspettati dei grassi nel diabete di tipo 2
Gli scienziati dell’UNIGE hanno scoperto che il grasso può aiutare il pancreas ad adattarsi allo zucchero in eccesso, rallentando l’insorgenza del diabete.
Con quasi il 10% della popolazione mondiale colpita, il diabete di tipo 2 rappresenta un grave problema di salute pubblica. Uno stile di vita eccessivamente sedentario e una dieta ipercalorica favoriscono lo sviluppo di questa malattia metabolica alterando il funzionamento delle cellule pancreatiche e rendendo meno efficace la regolazione degli zuccheri nel sangue.
Tuttavia, il grasso , che viene spesso citato come il colpevole ideale, potrebbe essere riabilitato. In realtà, il grasso non aggrava necessariamente la malattia e potrebbe addirittura svolgere un ruolo protettivo : studiando le cellule beta pancreatiche produttrici di insulina, gli scienziati dell’Università di Ginevra (UNIGE), in Svizzera, hanno dimostrato che queste cellule soffrono meno del grasso in eccesso. zucchero se precedentemente esposto al grasso.
Studiando i meccanismi cellulari in funzione, i ricercatori hanno scoperto come un ciclo di accumulo e mobilitazione del grasso consente alle cellule di adattarsi allo zucchero in eccesso . Questi risultati, pubblicati sulla rivista Diabetologia , evidenziano un meccanismo biologico inaspettato che potrebbe essere utilizzato come leva per ritardare l’insorgenza del diabete di tipo 2.
Il diabete di tipo 2 deriva da una disfunzione delle cellule beta del pancreas, responsabili della secrezione di insulina. Ciò influisce sulla regolazione dei livelli di zucchero nel sangue e può portare a gravi complicazioni al cuore, agli occhi e ai reni.
Negli anni ’70 venne messo in risalto il grasso ed emerse il concetto di lipotossicità : l’esposizione delle cellule beta al grasso ne causerebbe il deterioramento. Più recentemente, troppo zucchero è stato anche accusato di danneggiare le cellule beta e di promuovere lo sviluppo del diabete di tipo 2.
Tuttavia, anche se la responsabilità dello zucchero non è più in dubbio, il ruolo dei grassi nella disfunzione delle cellule beta rimane ambiguo. Quali sono i meccanismi cellulari coinvolti?
“Per rispondere a questa domanda chiave, abbiamo studiato come le cellule beta umane e murine si adattano a un eccesso di zuccheri e/o grassi”, spiega Pierre Maechler, professore presso il Dipartimento di Fisiologia e Metabolismo Cellulare e il Centro del Diabete della Facoltà UNIGE. di Medicina, che ha diretto questo lavoro.
Quando il grasso dà una mano alle cellule beta
Per differenziare gli effetti dei grassi da quelli degli zuccheri, gli scienziati hanno esposto le cellule beta a un eccesso di zucchero, a un eccesso di grasso e quindi a una combinazione di entrambi. La tossicità dello zucchero è stata confermata per la prima volta: le cellule beta esposte ad alti livelli di zucchero secernevano molta meno insulina del normale.
"Quando le cellule sono esposte sia a troppi zuccheri che a troppi grassi, immagazzinano grasso sotto forma di goccioline in previsione di tempi meno prosperi", spiega Lucie Oberhauser, ricercatrice presso il Dipartimento di Fisiologia cellulare e metabolismo della Facoltà di Medicina dell’UNIGE , e primo autore di questo lavoro.
| “Sorprendentemente, abbiamo dimostrato che questo stock di grasso, invece di peggiorare la situazione, consente di riportare la secrezione di insulina a livelli quasi normali ”. L’ adattamento delle cellule beta a determinati grassi contribuirebbe quindi a mantenere normali livelli di zucchero nel sangue”. |
L’uso adattivo essenziale del grasso
Analizzando ulteriormente i cambiamenti cellulari in gioco, il gruppo di ricerca si è reso conto che le goccioline di grasso non erano riserve statiche, ma il sito di un ciclo dinamico di stoccaggio e mobilitazione.
E grazie a queste molecole di grasso rilasciate, le cellule beta si adattano allo zucchero in eccesso e mantengono una secrezione di insulina quasi normale. "Questo rilascio di grasso non è un vero problema finché il corpo lo utilizza come fonte di energia", aggiunge Pierre Maechler.
“Per evitare di sviluppare il diabete, è importante dare a questo ciclo benefico la possibilità di essere attivo, ad esempio mantenendo un’attività fisica regolare”.
Gli scienziati stanno ora cercando di determinare il meccanismo attraverso il quale questo grasso rilasciato stimola la secrezione di insulina , sperando di scoprire un modo per ritardare l’insorgenza del diabete.