Arrière-plan
Le risque de maladie cardiovasculaire est accru chez les personnes infectées par le virus de l’immunodéficience humaine (VIH), des données sont donc nécessaires sur les stratégies de prévention primaire dans cette population.
Méthodes
Dans cet essai de phase 3, nous avons réparti au hasard 7 769 participants infectés par le VIH présentant un risque faible à modéré de maladie cardiovasculaire et recevant un traitement antirétroviral pour recevoir quotidiennement de la pitavastatine calcique (à la dose de 4 mg) ou un placebo.
Le critère de jugement principal était la survenue d’un événement cardiovasculaire indésirable majeur, défini comme un ensemble de décès cardiovasculaires, d’infarctus du myocarde, d’hospitalisation pour angor instable, d’accident vasculaire cérébral, d’accident ischémique transitoire, d’ischémie artérielle périphérique, de revascularisation ou de décès pour une cause indéterminée. .
Résultats
L’âge médian des participants était de 50 ans (intervalle interquartile : 45 à 55 ans) ; le nombre médian de CD4 était de 621 cellules par millimètre cube (intervalle interquartile, 448 à 827) et la valeur de l’ARN du VIH était inférieure à la quantification chez 5 250 des 5 997 participants (87,5 %) avec les données disponibles.
L’essai a été arrêté prématurément pour des raisons d’efficacité après un suivi médian de 5,1 ans (intervalle interquartile : 4,3 à 5,9).
L’incidence d’un événement cardiovasculaire indésirable majeur était de 4,81 pour 1 000 années-personnes dans le groupe pitavastatine et de 7,32 pour 1 000 années-personnes dans le groupe placebo (risque relatif, 0,65 ; intervalle de confiance [IC à 95 %], 0,48 à 0,90 ; P = 0,002).
Des symptômes d’origine musculaire sont survenus chez 91 participants (2,3 %) dans le groupe pitavastatine et 53 (1,4 %) dans le groupe placebo ; Le diabète sucré est survenu chez 206 participants (5,3 %) et 155 (4,0 %), respectivement.
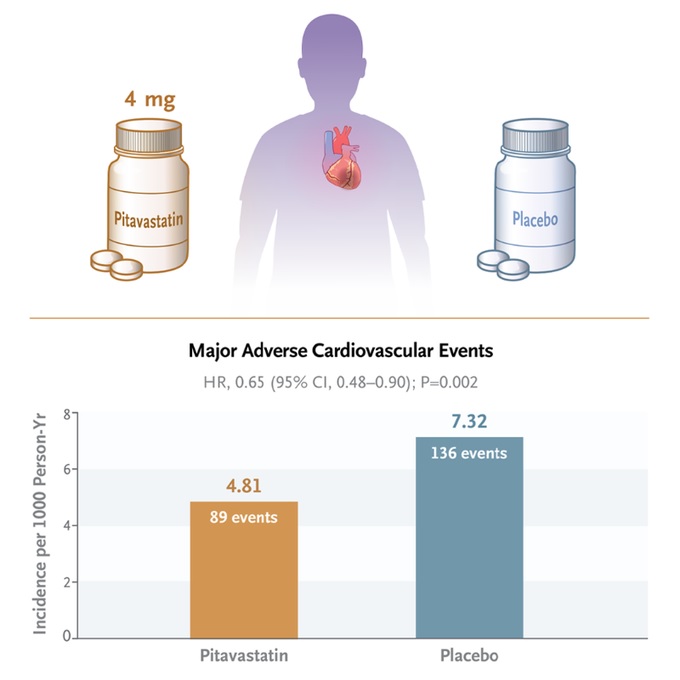
Conclusions Les participants infectés par le VIH qui ont reçu de la pitavastatine présentaient un risque plus faible d’événement cardiovasculaire indésirable majeur que ceux qui ont reçu un placebo au cours d’un suivi médian de 5,1 ans. |
(Financé par les National Institutes of Health et d’autres ; numéro REPRIEVE ClinicalTrials.gov, NCT02344290. s’ouvre dans un nouvel onglet.)
















