L’Assemblée Nobel de l’Institut Karolinska a décidé aujourd’hui d’attribuer conjointement le prix Nobel de physiologie ou médecine 2023 à Katalin Karikó et Drew Weissman pour leurs découvertes sur les modifications des bases nucléosidiques qui ont permis le développement de vaccins à ARNm efficaces contre le COVID-19.
Les découvertes des deux lauréats du prix Nobel ont joué un rôle déterminant dans le développement de vaccins à ARNm efficaces contre le COVID-19 pendant la pandémie qui a débuté début 2020. Grâce à leurs découvertes révolutionnaires, qui ont fondamentalement changé notre compréhension de la manière dont l’ARNm interagit avec notre système immunitaire, les lauréats ont contribué au rythme sans précédent de développement de vaccins au cours de l’une des plus grandes menaces pour la santé humaine des temps modernes.
Les vaccins avant la pandémie
La vaccination stimule la formation d’une réponse immunitaire contre un agent pathogène particulier. Cela donne à l’organisme un avantage dans la lutte contre les maladies en cas d’exposition ultérieure. Des vaccins basés sur des virus tués ou affaiblis sont disponibles depuis longtemps, comme les vaccins contre la polio, la rougeole et la fièvre jaune. En 1951, Max Theiler reçoit le prix Nobel de physiologie ou médecine pour avoir développé le vaccin contre la fièvre jaune.
Grâce aux progrès de la biologie moléculaire au cours des dernières décennies, les vaccins ont été développés sur la base de composants viraux individuels plutôt que de virus entiers. Des parties du code génétique viral, qui codent généralement pour les protéines présentes à la surface du virus, sont utilisées pour produire des protéines qui stimulent la formation d’anticorps bloquant le virus. Quelques exemples sont les vaccins contre le virus de l’hépatite B et le virus du papillome humain. Alternativement, des parties du code génétique viral peuvent être transférées vers un virus porteur inoffensif, un « vecteur ». Cette méthode est utilisée dans les vaccins contre le virus Ebola. Lorsque des vaccins vectoriels sont injectés, la protéine virale sélectionnée est produite dans nos cellules, ce qui stimule une réponse immunitaire contre le virus cible.
La production de vaccins à base de virus entiers, de protéines et de vecteurs nécessite une culture cellulaire à grande échelle. Ce processus gourmand en ressources limite les possibilités de production rapide de vaccins en réponse aux épidémies et aux pandémies. Par conséquent, les chercheurs tentent depuis longtemps de développer des technologies vaccinales indépendantes de la culture cellulaire, mais cela s’est avéré difficile.
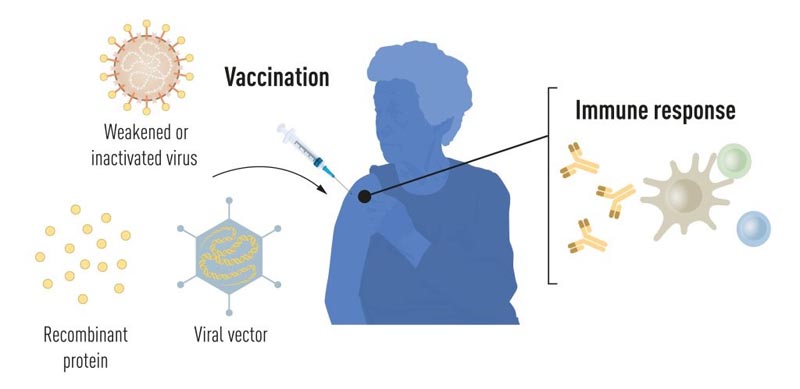
Figure 1. Méthodes de production de vaccins avant la pandémie de COVID-19 .
Vaccins à ARNm : une idée prometteuse
Dans nos cellules, l’information génétique codée dans l’ADN est transférée vers l’ARN messager (ARNm), qui sert de modèle pour la production de protéines. Des méthodes efficaces pour produire de l’ARNm sans culture cellulaire, appelées transcription in vitro, ont été introduites dans les années 1980. Cette étape décisive a accéléré le développement des applications de la biologie moléculaire dans divers domaines. L’idée d’utiliser les technologies de l’ARNm à des fins thérapeutiques et vaccinales a également pris son essor, mais il restait encore des obstacles à surmonter. L’ARNm transcrit in vitro était considéré comme instable et difficile à délivrer, ce qui nécessitait le développement de systèmes lipidiques porteurs sophistiqués pour encapsuler l’ARNm. De plus, l’ARNm produit in vitro a donné lieu à des réactions inflammatoires. Par conséquent, l’enthousiasme pour le développement de la technologie de l’ARNm à des fins cliniques était initialement limité.
Ces obstacles n’ont pas découragé la biochimiste hongroise Katalin Karikó, qui s’est consacrée au développement de méthodes permettant d’utiliser l’ARNm à des fins thérapeutiques. Au début des années 1990, alors qu’elle était professeure adjointe à l’Université de Pennsylvanie, elle est restée fidèle à sa vision de la réalisation de l’ARNm à des fins thérapeutiques malgré les difficultés rencontrées pour convaincre les bailleurs de fonds de la recherche de l’importance de son projet. . Un nouveau collègue de Karikó dans son université était l’immunologiste Drew Weissman. Il s’intéressait aux cellules dendritiques, qui jouent un rôle important dans la surveillance immunitaire et l’activation des réponses immunitaires induites par le vaccin. Encouragée par de nouvelles idées, une collaboration fructueuse entre les deux a rapidement commencé, axée sur la manière dont différents types d’ARN interagissent avec le système immunitaire.
La grande avancée
Karikó et Weissman ont observé que les cellules dendritiques reconnaissent l’ARNm transcrit in vitro comme substance étrangère, conduisant à leur activation et à la libération de molécules de signalisation inflammatoires. Ils se demandaient pourquoi les ARNm transcrits in vitro étaient reconnus comme étrangers, alors que les ARNm issus de cellules de mammifères ne provoquaient pas la même réaction. Karikó et Weissman ont réalisé que certaines propriétés critiques doivent distinguer différents types d’ARNm.
L’ARN contient quatre bases, abrégées A, U, G et C, qui correspondent à A, T, G et C dans l’ADN, les lettres du code génétique. Karikó et Weissman savaient que les bases de l’ARN des cellules de mammifères sont souvent chimiquement modifiées, alors que l’ARNm transcrit in vitro ne l’est pas. Ils se sont demandés si l’absence de bases altérées dans l’ARN transcrit in vitro pouvait expliquer la réaction inflammatoire indésirable.
Pour étudier cela, ils ont produit différentes variantes d’ARNm, chacune présentant des altérations chimiques uniques dans leurs bases, qu’ils ont transmises aux cellules dendritiques. Les résultats ont été surprenants : la réponse inflammatoire était presque supprimée lorsque des modifications de bases étaient incluses dans l’ARNm. Il s’agissait d’un changement de paradigme dans notre compréhension de la façon dont les cellules reconnaissent et réagissent aux différentes formes d’ARNm. Karikó et Weissman ont immédiatement compris que leur découverte avait une profonde importance pour l’utilisation de l’ARNm en thérapie. Ces résultats déterminants ont été publiés en 2005, quinze ans avant la pandémie de COVID-19.

Figure 2 . L’ARNm contient quatre bases différentes, abrégées A, U, G et C. Les lauréats du prix Nobel ont découvert que l’ARNm modifié par une base peut être utilisé pour bloquer l’activation des réactions inflammatoires (sécrétion de molécules de signalisation) et augmenter la production de protéines lorsque l’ARNm est délivré au cellules.
Dans des études supplémentaires publiées en 2008 et 2010, Karikó et Weissman ont démontré que la délivrance d’ARNm généré avec des modifications de bases augmentait nettement la production de protéines par rapport à l’ARNm non modifié. L’effet était dû à l’activation réduite d’une enzyme qui régule la production de protéines. Grâce à leurs découvertes selon lesquelles les modifications de bases réduisaient les réponses inflammatoires et augmentaient la production de protéines, Karikó et Weissman avaient éliminé des obstacles critiques sur la voie des applications cliniques de l’ARNm.
Les vaccins à ARNm ont découvert leur potentiel
L’intérêt pour la technologie de l’ARNm a commencé à augmenter et, en 2010, plusieurs entreprises travaillaient au développement de la méthode. Des vaccins contre le virus Zika et le MERS-CoV ont été recherchés ; ce dernier est étroitement lié au SRAS-CoV-2. Après le déclenchement de la pandémie de COVID-19, deux vaccins à ARNm avec des bases modifiées codant pour la protéine de surface du SRAS-CoV-2 ont été développés à un rythme record. Des effets protecteurs d’environ 95 % ont été signalés et les deux vaccins ont été approuvés dès décembre 2020.
La flexibilité et la rapidité impressionnantes avec lesquelles les vaccins à ARNm peuvent être développés ouvrent également la voie à l’utilisation de la nouvelle plateforme pour des vaccins contre d’autres maladies infectieuses. À l’avenir, cette technologie pourrait également être utilisée pour délivrer des protéines thérapeutiques et traiter certains types de cancer.
D’autres vaccins contre le SRAS-CoV-2, basés sur différentes méthodologies, ont également été rapidement introduits, et ensemble, plus de 13 milliards de doses de vaccin contre la COVID-19 ont été administrées dans le monde. Les vaccins ont sauvé des millions de vies et évité des maladies graves chez beaucoup d’autres, permettant ainsi aux sociétés de s’ouvrir et de revenir à des conditions normales. Grâce à leurs découvertes fondamentales sur l’importance des modifications de bases dans l’ARNm, les lauréats du prix Nobel de cette année ont apporté une contribution fondamentale à ce développement transformateur au cours de l’une des plus grandes crises sanitaires de notre époque.
Publications clés
- Karikó, K., Buckstein, M., Ni, H. et Weissman, D. Suppression de la reconnaissance de l’ARN par les récepteurs de type Toll : l’impact de la modification des nucléosides et l’origine évolutive de l’ARN. Immunité 23, 165-175 (2005).
- Karikó, K., Muramatsu, H., Welsh, FA, Ludwig, J., Kato, H., Akira, S. et Weissman, D. L’incorporation de pseudouridine dans l’ARNm produit un vecteur non immunogène supérieur avec une plus grande capacité de traduction et stabilité biologique. Mol Ther 16, 1833-1840 (2008).
- Anderson, BR, Muramatsu, H., Nallagatla, SR, Bevilacqua, PC, Sansing, LH, Weissman, D. et Karikó, K. L’incorporation de pseudouridine dans l’ARNm améliore la traduction en diminuant l’activation de la PKR. Acides nucléiques Res. 38, 5884-5892 (2010).

Biographies
Katalin Karikó est née en 1955 à Szolnok, en Hongrie. Elle a obtenu son doctorat à l’Université de Szeged en 1982 et a mené des recherches postdoctorales à l’Académie hongroise des sciences de Szeged jusqu’en 1985. Elle a ensuite mené des recherches postdoctorales à l’Université Temple de Philadelphie et à l’Université des sciences de la santé de Bethesda. En 1989, elle est nommée professeur adjoint à l’Université de Pennsylvanie, où elle reste jusqu’en 2013. Elle devient ensuite vice-présidente puis vice-présidente senior de BioNTech RNA Pharmaceuticals. Depuis 2021, elle est professeur à l’Université de Szeged et professeur adjoint à la Perelman School of Medicine de l’Université de Pennsylvanie.
Drew Weissman est né en 1959 à Lexington, Massachusetts, États-Unis. Il a obtenu son doctorat en médecine et son doctorat à l’Université de Boston en 1987. Il a complété sa formation clinique au Beth Israel Deaconess Medical Center de la Harvard Medical School et a mené des recherches postdoctorales aux National Institutes of Health. En 1997, Weissman a créé son groupe de recherche à la Perelman School of Medicine de l’Université de Pennsylvanie. Il est professeur de la famille Roberts en recherche sur les vaccins et directeur du Penn Institute for RNA Innovations.
Illustrations : © Comité Nobel de physiologie ou médecine. Illustrateur : Mattías Karlén
L’Assemblée Nobel, composée de 50 professeurs de l’Institut Karolinska, décerne le prix Nobel de physiologie ou médecine. Son comité Nobel évalue les nominations. Depuis 1901, le prix Nobel est décerné aux scientifiques qui ont réalisé les découvertes les plus importantes au profit de l’humanité.