Die Nobelversammlung am Karolinska-Institut hat heute beschlossen, den Nobelpreis für Physiologie oder Medizin 2023 gemeinsam an Katalin Karikó und Drew Weissman für ihre Entdeckungen zu Nukleosidbasenmodifikationen zu verleihen, die die Entwicklung wirksamer mRNA-Impfstoffe gegen COVID-19 ermöglichten.
Die Entdeckungen der beiden Nobelpreisträger waren maßgeblich an der Entwicklung wirksamer mRNA-Impfstoffe gegen COVID-19 während der Anfang 2020 beginnenden Pandemie beteiligt. Durch ihre bahnbrechenden Entdeckungen, die unser Verständnis der Interaktion von mRNA mit unserem Immunsystem grundlegend verändert haben, leisteten die Preisträger einen Beitrag auf die beispiellose Geschwindigkeit der Impfstoffentwicklung während einer der größten Bedrohungen für die menschliche Gesundheit in der Neuzeit.
Impfstoffe vor der Pandemie
Die Impfung stimuliert die Bildung einer Immunantwort auf einen bestimmten Krankheitserreger. Dies verschafft dem Körper einen Vorteil bei der Bekämpfung von Krankheiten im Falle einer späteren Exposition. Impfstoffe auf Basis abgetöteter oder abgeschwächter Viren gibt es schon lange, etwa gegen Polio, Masern und Gelbfieber. 1951 erhielt Max Theiler für die Entwicklung des Gelbfieberimpfstoffs den Nobelpreis für Physiologie oder Medizin.
Dank der Fortschritte in der Molekularbiologie in den letzten Jahrzehnten wurden Impfstoffe entwickelt, die auf einzelnen Viruskomponenten und nicht auf ganzen Viren basieren. Teile des viralen genetischen Codes, die typischerweise Proteine kodieren, die sich auf der Oberfläche des Virus befinden, werden zur Herstellung von Proteinen verwendet, die die Bildung virusblockierender Antikörper stimulieren. Einige Beispiele sind Impfstoffe gegen das Hepatitis-B-Virus und das humane Papillomavirus. Alternativ können Teile des viralen genetischen Codes in ein harmloses Trägervirus, einen „Vektor“, verschoben werden. Diese Methode wird bei Impfstoffen gegen das Ebola-Virus eingesetzt. Bei der Injektion von Vektorimpfstoffen wird in unseren Zellen das ausgewählte Virusprotein produziert, das eine Immunantwort gegen das Zielvirus stimuliert.
Die Herstellung von Impfstoffen auf der Basis ganzer Viren, Proteine und Vektoren erfordert Zellkulturen im großen Maßstab. Dieser ressourcenintensive Prozess schränkt die Möglichkeiten einer schnellen Impfstoffproduktion als Reaktion auf Ausbrüche und Pandemien ein. Daher versuchen Forscher seit langem, zellkulturunabhängige Impfstofftechnologien zu entwickeln, was sich jedoch als Herausforderung erweist.
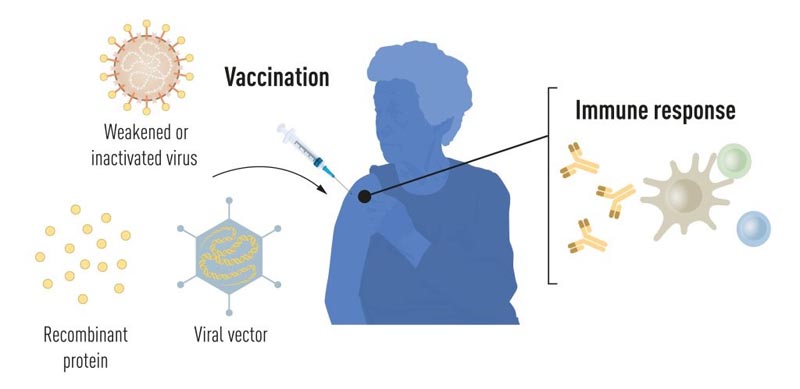
Abbildung 1. Methoden zur Impfstoffproduktion vor der COVID-19-Pandemie .
mRNA-Impfstoffe: eine vielversprechende Idee
In unseren Zellen wird die in der DNA kodierte genetische Information auf Boten-RNA (mRNA) übertragen, die als Vorlage für die Proteinproduktion dient. In den 1980er Jahren wurden effiziente Methoden zur Herstellung von mRNA ohne Zellkultur eingeführt, die als In-vitro-Transkription bezeichnet werden. Dieser entscheidende Schritt beschleunigte die Entwicklung molekularbiologischer Anwendungen in verschiedenen Bereichen. Auch die Idee, mRNA-Technologien für Therapeutika und Impfstoffe einzusetzen, kam auf, es gab jedoch noch Hindernisse. In vitro transkribierte mRNA galt als instabil und schwer zu transportieren, was die Entwicklung hochentwickelter Trägerlipidsysteme zur Einkapselung der mRNA erforderte. Darüber hinaus führte in vitro produzierte mRNA zu Entzündungsreaktionen. Daher war die Begeisterung für die Entwicklung der mRNA-Technologie für klinische Zwecke zunächst begrenzt.
Diese Hindernisse entmutigten die ungarische Biochemikerin Katalin Karikó nicht, die sich der Entwicklung von Methoden zur Verwendung von mRNA für therapeutische Zwecke widmete. Als sie Anfang der 1990er Jahre Assistenzprofessorin an der University of Pennsylvania war, blieb sie ihrer Vision treu, mRNA als Therapeutikum umzusetzen, obwohl sie Schwierigkeiten hatte, Forschungsförderer von der Bedeutung ihres Projekts zu überzeugen. . Ein neuer Kollege von Karikó an ihrer Universität war der Immunologe Drew Weissman. Er interessierte sich für dendritische Zellen, die eine wichtige Rolle bei der Immunüberwachung und der Aktivierung impfstoffinduzierter Immunantworten spielen. Angeregt durch neue Ideen begann bald eine fruchtbare Zusammenarbeit zwischen den beiden, bei der es darum ging, wie verschiedene Arten von RNA mit dem Immunsystem interagieren.
Der große Fortschritt
Karikó und Weissman beobachteten, dass dendritische Zellen in vitro transkribierte mRNA als Fremdsubstanz erkennen, was zu ihrer Aktivierung und der Freisetzung entzündlicher Signalmoleküle führt. Sie fragten sich, warum in vitro transkribierte mRNA als fremd erkannt wurde, während mRNA aus Säugetierzellen nicht zu derselben Reaktion führte. Karikó und Weissman erkannten, dass einige kritische Eigenschaften verschiedene Arten von mRNA unterscheiden müssen.
RNA enthält vier Basen, abgekürzt A, U, G und C, die A, T, G und C in der DNA entsprechen, den Buchstaben des genetischen Codes. Karikó und Weissman wussten, dass die Basen der RNA aus Säugetierzellen oft chemisch verändert sind, während dies bei in vitro transkribierter mRNA nicht der Fall ist. Sie fragten sich, ob das Fehlen veränderter Basen in der in vitro transkribierten RNA die unerwünschte Entzündungsreaktion erklären könnte.
Um dies zu untersuchen, produzierten sie verschiedene mRNA-Varianten mit jeweils einzigartigen chemischen Veränderungen in ihren Basen, die sie an dendritische Zellen weitergaben. Die Ergebnisse waren überraschend: Durch den Einbau von Basenmodifikationen in die mRNA wurde die Entzündungsreaktion nahezu aufgehoben. Dies war ein Paradigmenwechsel in unserem Verständnis darüber, wie Zellen verschiedene Formen von mRNA erkennen und darauf reagieren. Karikó und Weissman erkannten sofort, dass ihre Entdeckung für den Einsatz von mRNA als Therapie von großer Bedeutung war. Diese entscheidenden Ergebnisse wurden 2005 veröffentlicht, fünfzehn Jahre vor der COVID-19-Pandemie.

Figur 2 . mRNA enthält vier verschiedene Basen, abgekürzt A, U, G und C. Nobelpreisträger entdeckten, dass basenmodifizierte mRNA verwendet werden kann, um die Aktivierung von Entzündungsreaktionen (Sekretion von Signalmolekülen) zu blockieren und die Proteinproduktion zu steigern, wenn die mRNA an die Zelle abgegeben wird Zellen.
In weiteren Studien, die 2008 und 2010 veröffentlicht wurden, zeigten Karikó und Weissman, dass die Verabreichung von mRNA, die mit Basenmodifikationen erzeugt wurde, die Proteinproduktion im Vergleich zu unmodifizierter mRNA deutlich steigerte. Der Effekt beruhte auf einer verminderten Aktivierung eines Enzyms, das die Proteinproduktion reguliert. Dank ihrer Entdeckung, dass Basenmodifikationen Entzündungsreaktionen reduzierten und die Proteinproduktion steigerten, hatten Karikó und Weissman entscheidende Hindernisse auf dem Weg zu klinischen Anwendungen von mRNA beseitigt.
mRNA-Impfstoffe haben ihr Potenzial entdeckt
Das Interesse an der mRNA-Technologie nahm zu und bis 2010 arbeiteten mehrere Unternehmen an der Entwicklung der Methode. Gesucht wurden Impfstoffe gegen das Zika-Virus und MERS-CoV; Letzteres ist eng mit SARS-CoV-2 verwandt. Nach Ausbruch der COVID-19-Pandemie wurden in Rekordtempo zwei mRNA-Impfstoffe mit modifizierten Basen entwickelt, die das Oberflächenprotein von SARS-CoV-2 kodieren. Es wurde eine Schutzwirkung von rund 95 % gemeldet und beide Impfstoffe wurden bereits im Dezember 2020 zugelassen.
Die beeindruckende Flexibilität und Geschwindigkeit, mit der mRNA-Impfstoffe entwickelt werden können, ebnen den Weg, die neue Plattform auch für Impfstoffe gegen andere Infektionskrankheiten zu nutzen. In Zukunft könnte die Technologie auch zur Bereitstellung therapeutischer Proteine und zur Behandlung einiger Krebsarten eingesetzt werden.
Auch andere SARS-CoV-2-Impfstoffe, die auf anderen Methoden basieren, wurden rasch eingeführt, und insgesamt wurden weltweit mehr als 13 Milliarden COVID-19-Impfstoffdosen verabreicht. Impfstoffe haben Millionen von Menschenleben gerettet und bei vielen weiteren Menschen schwere Krankheiten verhindert und so die Öffnung der Gesellschaft und die Rückkehr zu normalen Bedingungen ermöglicht. Durch ihre grundlegenden Entdeckungen zur Bedeutung von Basenmodifikationen in mRNA haben die diesjährigen Nobelpreisträger einen grundlegenden Beitrag zu dieser transformativen Entwicklung während einer der größten Gesundheitskrisen unserer Zeit geleistet.
Wichtige Veröffentlichungen
- Karikó, K., Buckstein, M., Ni, H. und Weissman, D. Unterdrückung der RNA-Erkennung durch Toll-like-Rezeptoren: der Einfluss der Nukleosidmodifikation und der evolutionäre Ursprung von RNA. Immunity 23, 165-175 (2005).
- Karikó, K., Muramatsu, H., Welsh, FA, Ludwig, J., Kato, H., Akira, S. und Weissman, D. Der Einbau von Pseudouridin in mRNA erzeugt einen überlegenen nicht-immunogenen Vektor mit größerer Translationskapazität und biologische Stabilität. Mol Ther 16, 1833–1840 (2008).
- Anderson, BR, Muramatsu, H., Nallagatla, SR, Bevilacqua, PC, Sansing, LH, Weissman, D. und Karikó, K. Der Einbau von Pseudouridin in mRNA verbessert die Translation durch Verringerung der PKR-Aktivierung. Nukleinsäuren Res. 38, 5884–5892 (2010).

Biografien
Katalin Karikó wurde 1955 in Szolnok, Ungarn geboren. Sie promovierte 1982 an der Universität Szeged und forschte bis 1985 als Postdoktorandin an der Ungarischen Akademie der Wissenschaften in Szeged. Anschließend forschte sie als Postdoktorandin an der Temple University in Philadelphia und der University of Health Sciences in Bethesda. 1989 wurde sie zur Assistenzprofessorin an der University of Pennsylvania ernannt, wo sie bis 2013 blieb. Danach wurde sie Vizepräsidentin und dann Senior Vice President von BioNTech RNA Pharmaceuticals. Seit 2021 ist sie Professorin an der Universität Szeged und außerordentliche Professorin an der Perelman School of Medicine der University of Pennsylvania.
Drew Weissman wurde 1959 in Lexington, Massachusetts, USA, geboren. Er erhielt 1987 seinen MD und Ph.D. von der Boston University. Er absolvierte seine klinische Ausbildung am Beth Israel Deaconess Medical Center der Harvard Medical School und forschte als Postdoktorand an den National Institutes of Health. 1997 gründete Weissman seine Forschungsgruppe an der Perelman School of Medicine der University of Pennsylvania. Er ist Roberts Family Professor für Impfstoffforschung und Direktor des Penn Institute for RNA Innovations.
Illustrationen: © Nobelkomitee für Physiologie oder Medizin. Illustrator: Mattías Karlén
Die Nobelversammlung, bestehend aus 50 Professoren des Karolinska-Instituts, vergibt den Nobelpreis für Physiologie oder Medizin. Sein Nobelkomitee bewertet die Nominierungen. Seit 1901 wird der Nobelpreis an Wissenschaftler verliehen, die die wichtigsten Entdeckungen zum Wohle der Menschheit gemacht haben.