Les valvulopathies cardiaques constituent une source majeure de morbidité et de mortalité cardiovasculaires dans le monde.
Parmi les nombreuses avancées récentes figurent ( a ) une plus grande reconnaissance de l’impact de la fibrillation auriculaire (FA) sur le développement et l’évaluation des valvulopathies, ( b ) de nouvelles stratégies pour la prévention mondiale des cardiopathies rhumatismales (RC), ( c ) une amélioration compréhension et traitement de l’insuffisance mitrale secondaire (SMI), ( d ) une classification mise à jour de la maladie valvulaire aortique bicuspide (BAV), et ( e ) la reconnaissance du risque cardiovasculaire accru associé à la sténose aortique (SA) modérée.
De plus, avec le vieillissement de la population et l’épidémie émergente de valvulopathies dégénératives et fonctionnelles, de plus en plus de thérapies par cathéter deviennent disponibles et font l’objet d’essais cliniques rigoureux. Cette revue fournit une mise à jour sur ces sujets en mettant l’accent sur les preuves récentes et les orientations futures.
| Changements mondiaux dans l’épidémiologie des valvulopathies cardiaques |
fibrillation auriculaire
Un cœur dans lequel survient la FA est caractérisé phénotypiquement par des oreillettes plus grandes, une résistance vasculaire pulmonaire accrue, une insuffisance cardiaque droite, une diminution du débit vers l’avant, une diminution de la réserve de débit cardiaque et une augmentation du confinement péricardique, qui contribuent tous à des résultats indésirables.
La FA partage des facteurs de risque cardiovasculaires communs impliqués dans la maladie valvulaire dégénérative, notamment, mais sans s’y limiter, l’âge avancé, l’hypertension, le diabète et l’hyperlipidémie. Par conséquent, la prévalence de la FA dans les valvulopathies rhumatismales ou non rhumatismales est très élevée, en particulier chez les personnes atteintes d’une valvulopathie modérée à sévère.
Les complications de la FA coexistante chez les patients atteints de valvulopathie comprennent un risque accru d’accident vasculaire cérébral et d’embolisation systémique, ainsi qu’un risque accru de mortalité cardiovasculaire et toutes causes confondues.
Cardiopathie rhumatismale : prévention et traitement
La CR est une conséquence du rhumatisme articulaire aigu (FR) provoqué par une infection de l’angine à streptocoque du groupe A. Les facteurs de risque d’infections streptococciques du groupe A à forte incidence comprennent la pauvreté et un accès limité aux soins de santé. L’amélioration du statut socio-économique et l’accès à des soins de santé adéquats, qui réduisent le risque de transmission et d’infection par les streptocoques du groupe A, ainsi que la détection et le traitement précoces et opportuns de ces infections, réduisent considérablement l’incidence du FR et constituent la pierre angulaire des soins primaires. .
La prévention secondaire, visant à prévenir la récidive du FR et la progression de la CR établie, est assurée par la benzathine pénicilline G administrée par voie intramusculaire toutes les 3 ou 4 semaines, mais l’accès à ce médicament a été très difficile dans les zones d’endémie, en partie à cause de la diminution de l’approvisionnement en le médicament. La valvoplastie par ballon mitral et la réparation/remplacement valvulaire sont nécessaires en cas de RC sévère symptomatique, mais pour ces interventions, les ressources sont également rares là où la RF et la CR sont endémiques.
La sténose mitrale rhumatismale est la maladie valvulaire sous-jacente la plus courante chez les patients des pays à revenu faible ou intermédiaire qui présentent une fibrillation auriculaire.
Il existe un engagement renouvelé et intense de la part de l’Organisation mondiale de la santé, de la Fédération mondiale du cœur et de l’American Heart Association, entre autres organisations internationales et mondiales, pour prévenir et contrôler les RF et CR, compte tenu de la persistance de ces maladies. dans les pays à revenu faible ou intermédiaire.
| Insuffisance mitrale secondaire : physiopathologie et prise en charge |
Traditionnellement, le MSI a été considéré comme une maladie du ventricule gauche (VG), avec des anomalies régionales du mouvement de la paroi conduisant à un blocage du mouvement des feuillets et à une coaptation incomplète chez les patients présentant des feuillets de la valve mitrale normaux ou presque normaux. ( Figure 1 ). La situation est cependant plus complexe en raison de l’hétérogénéité du SMI.
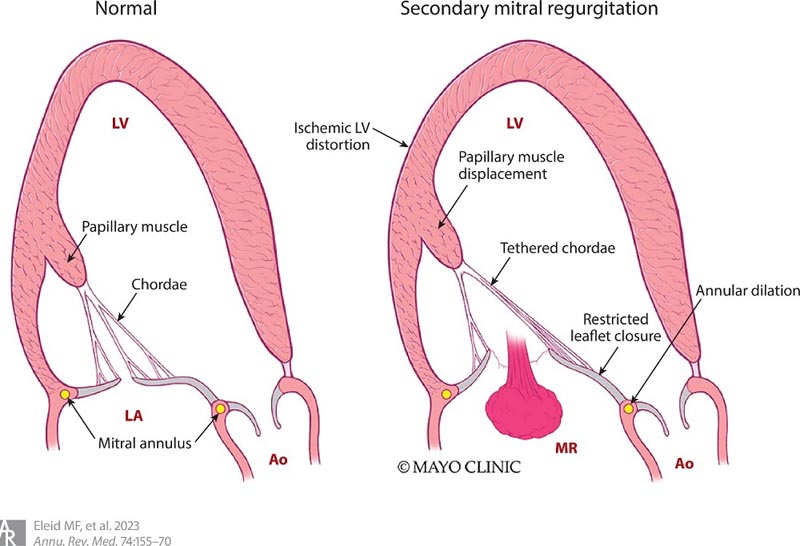
Figure 1 . La physiopathologie et les mécanismes de l’insuffisance mitrale secondaire comprennent une dilatation ventriculaire gauche entraînant un déplacement du muscle papillaire, un attachement des cordes et une fermeture restreinte des feuillets, ainsi qu’un élargissement de l’oreillette gauche et de l’anneau mitral. Abréviations : Ao, aorte ; LA, oreillette gauche ; VI, ventricule gauche ; IRM : insuffisance de la valvule mitrale.
À une extrémité du spectre se trouvent les MSI avec dilatation du VG conduisant à une distorsion globale du fonctionnement de l’appareil valvulaire mitral et, en particulier, une dilatation annulaire. Dans cette situation, l’insuffisance mitrale est essentiellement passive et l’objectif principal du traitement est de traiter le dysfonctionnement du VG et de réduire sa taille. À l’inverse, les processus pathologiques affectant le myocarde ventriculaire peuvent impliquer de manière disproportionnée des segments soutenant l’appareil valvulaire mitral en provoquant une immobilisation des feuillets et un épaississement et un dysfonctionnement ultérieurs.
D’un point de vue thérapeutique, plusieurs problématiques doivent être abordées. Étant donné que le dysfonctionnement du VG (à la fois mondial et régional) fait partie intégrante du MSI, il doit être traité à l’aide d’approches pharmacologiques déterminées par des lignes directrices et peut-être d’un traitement de resynchronisation cardiaque chez des patients hautement sélectionnés.
Chez les patients atteints de maladie coronarienne, la revascularisation seule a eu un effet incohérent sur la gravité de la MR. Le problème chez les patients atteints d’IMS subissant un pontage aorto-coronarien (PAC) est plus nuancé ; Il n’a pas été complètement déterminé si un PAC seul ou un PAC avec réparation ou remplacement de la valvule mitrale devait être réalisé, en particulier chez les patients ne présentant pas de symptômes d’insuffisance cardiaque.
Pour les patients subissant un PAC chez lesquels un MSI est présent mais n’est pas considéré comme la cause des symptômes, les options incluent le PAC seul, le PAC plus réparation ou de préférence le remplacement de la valvule mitrale, ou le PAC seul suivi d’une observation étroite avec l’option d’une procédure percutanée.
Chez les patients présentant un MSI symptomatique, il est important de déterminer si les symptômes sont secondaires à une congestion (c.-à-d. dyspnée) ou peut-être à un faible débit cardiaque (fatigue), conséquence de la gravité du dysfonctionnement, du remodelage et des cicatrices du VG. et si le degré d’IM est proportionnel ou disproportionné au degré de
Dilatation du VG ( figure 2 ). Ce qui est sûr, c’est que le traitement percutané et chirurgical des MSI évolue et fait aujourd’hui l’objet d’un arsenal technologique en pleine expansion.
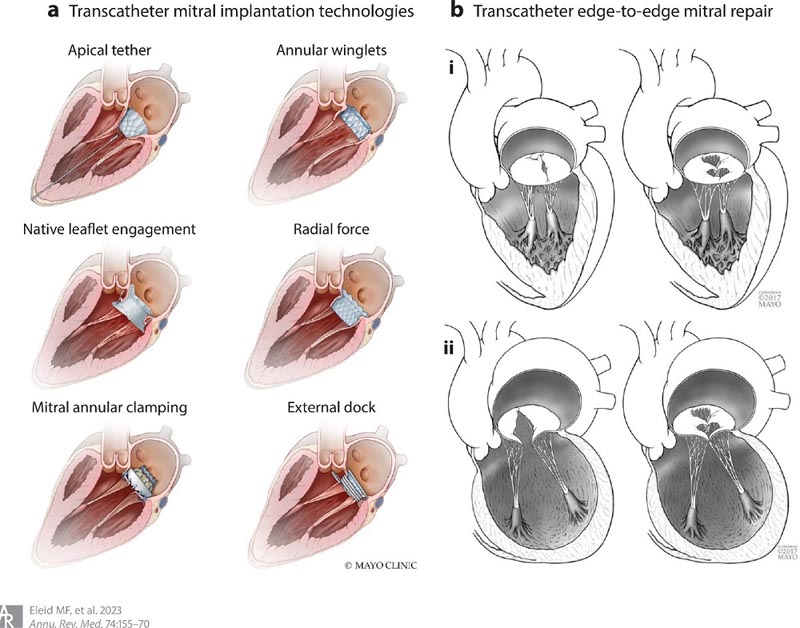
Figure 2 . (a) Dispositifs d’implantation percutanée de la valvule mitrale et leurs mécanismes d’ancrage respectifs. (b) Réparation bord à bord par cathéter de la valvule mitrale dans les régurgitations mitrales primaires (i) et secondaires (ii).
L’association étiologique de la FA/flutter avec la régurgitation mitrale n’est pas contestée. Cependant, ce que nous ne savons pas, c’est quelle proportion de patients présentant une FA/flutter incident et sans valvulopathie cardiaque préexistante au moment du diagnostic développeront des anomalies valvulaires significatives. Cette question fait l’objet d’études en cours, qui devraient permettre de clarifier l’ampleur du problème.
| Approches interventionnelles pour la maladie de la valvule mitrale |
L’insuffisance mitrale est divisée en étiologies primaires et secondaires, qui sont très importantes pour décider du traitement optimal.
La maladie primaire de la valvule mitrale comprend des étiologies dégénératives telles que le déficit fibroélastique et le prolapsus de la valvule mitrale, qui sont plus fréquents dans les pays à revenu élevé, tandis que la maladie rhumatismale de la valvule mitrale est plus fréquente dans les pays à revenu faible ou intermédiaire. L’endocardite et la valvulopathie mitrale calcifiée sont d’autres causes importantes de maladie primaire de la valvule mitrale.
La réparation chirurgicale de la valvule mitrale est l’intervention de choix pour les patients atteints d’IRM primaire sévère qui ont une anatomie valvulaire mitrale adéquate. Cependant, de nombreux patients ne disposent pas d’une anatomie adéquate pour la réparation ou présentent un risque accru de mortalité par chirurgie cardiaque en raison de l’âge, de comorbidités ou de déficiences techniques. Pour ces patients, un nombre croissant de thérapies par cathéter sont utilisées pour traiter un large éventail de maladies de la valvule mitrale.
L’implantation de la valve mitrale par cathéter est une nouvelle stratégie de traitement mini-invasive pour les patients atteints d’une maladie valvulaire mitrale sévère à haut risque de chirurgie, ainsi que pour les patients présentant une sténose mitrale calcifiée due à une calcification de l’anneau mitral. L’implantation transseptale de valves expansibles par ballonnet transcathéter pour les patients porteurs de bioprothèses mitrales dégénérées après le perfectionnement initial de la procédure est devenue une procédure sûre et efficace approuvée par la Food and Drug Administration (FDA) des États-Unis.
| Sténose aortique : sous-ensembles hémodynamiques et nouvelles indications thérapeutiques |
Implantation valvulaire aortique par cathéter
Depuis la procédure humaine initiale il y a 20 ans, l’implantation valvulaire aortique par cathéter (TAVI) a connu un développement riche et rigoureux grâce à une collaboration interdisciplinaire et des essais cliniques randomisés pour devenir une thérapie courante et hautement efficace. Les premières études sur le TAVI chez des patients présentant un risque élevé ou prohibitif de chirurgie ont établi la faisabilité de la procédure mais ont identifié des domaines à améliorer, notamment la fuite paravalvulaire (PVL) et le risque de complications vasculaires.
Ces complications sont désormais rares avec TAVI grâce aux améliorations apportées à la technologie des appareils, à la technique procédurale, à la planification basée sur la tomodensitométrie et à la sélection des patients. TAVI est désormais un traitement de première intention pour les patients atteints de SA présentant un risque intermédiaire ou plus élevé de remplacement chirurgical de la valvule aortique
TAVI est actuellement recommandé comme indication de classe I dans les récentes lignes directrices sur les maladies valvulaires cardiaques de l’American Heart Association et de l’American College of Cardiology pour les patients atteints de SA qui présentent un faible risque de remplacement chirurgical de la valvule aortique et sont des candidats appropriés pour une prothèse biologique avec un espérance de vie de 20 ans. ans ou moins
Sténose aortique modérée
Des données récentes de la pratique contemporaine suggèrent un pronostic défavorable chez les patients atteints de MA modérée ; Certaines données suggèrent une mortalité tout aussi élevée associée à la MA modérée et sévère lorsqu’elle n’est pas traitée, mais il n’est pas clair si l’augmentation de la mortalité était liée à des comorbidités.
Une mortalité accrue a été associée à une réduction de la FEVG (<50 %), à un dysfonctionnement diastolique, à une insuffisance cardiaque clinique, à une souche globale anormale du VG et à une élévation du peptide natriurétique de type pro B N-terminal . Des essais cliniques examinant le TAVI par rapport au traitement médical prescrit chez les patients atteints de SA symptomatique modérée sont en cours.
Sténose aortique à faible gradient
Les déterminants fondamentaux du gradient moyen à travers la valvule aortique sont la surface et le débit direct. Une petite surface valvulaire aortique (≤1 cm2), associée à un faible gradient (<40 mm Hg) et une vitesse maximale (<4 m/sec), définit la sténose aortique à faible gradient (LGAS). Le LGAS survient généralement en raison d’un faible débit vers l’avant, en supposant qu’il n’y a pas d’erreurs de mesure, ou d’une postcharge transvalvulaire élevée (c’est-à-dire une hypertension systémique). Toute condition entraînant un faible débit direct peut entraîner un LGAS. Le traitement de l’hypertension systémique dans le LGAS est associé à une réduction des pressions de remplissage du VG et à une augmentation du débit direct, et est recommandé comme étape importante du traitement.
Valve aortique bicuspide
La maladie BAV est la cardiopathie congénitale la plus courante, touchant 1 à 2 % de la population générale. Les déterminants génétiques de la maladie BAV contribuent également à l’aortopathie, présente chez 50 % des patients atteints de la maladie BAV et caractérisée par une intégrité structurelle et une élasticité réduites de la paroi aortique.
Une dynamique anormale du flux à travers un BAV, en particulier lorsqu’elle est associée à une sténose ou une régurgitation progressive, contribue également à la dilatation aortique. Les phénotypes les plus courants sont la fusion des cuspides coronaires droite et gauche, suivie de la fusion des cuspides droites et non coronaires.
| Régurgitation valvulaire tricuspide |
Moment d’intervention
Les lignes directrices actuelles recommandent l’intervention de la valvule tricuspide en cas de régurgitation tricuspide primaire (TR) lorsqu’il existe des symptômes ou lorsqu’il existe au moins une dilatation ventriculaire droite (RV) progressive ou un dysfonctionnement systolique, ou lorsqu’il existe une TR ou une dilatation annulaire significative. tricuspide lors d’une chirurgie à cœur ouvert pour une maladie cardiaque gauche.
La TR reste largement sous-traitée, et la récente tendance légèrement à la hausse de la chirurgie valvulaire tricuspide pour la TR, en particulier la réparation, a également été associée à l’âge des patients et aux comorbidités au moment de la chirurgie. Des mesures quantitatives plus précises de la taille du VD et de la fonction systolique (par exemple, échocardiographie 3D ou IRM cardiaque) et l’identification de déclencheurs précoces de chirurgie valvulaire tricuspide sont activement étudiées pour améliorer les résultats.
Approches interventionnelles tricuspides par cathéter
Seulement 10 % des patients présentant une TR symptomatique sévère subissent un traitement chirurgical, alors que la majorité est traitée uniquement par un traitement diurétique. Compte tenu de l’impact négatif d’une TR sévère sur la qualité de vie et la survie, et du degré extrême de TR observé chez une grande proportion de patients, il existe un grand besoin de thérapies transcathéter mini-invasives.
De nombreuses thérapies par cathéter sont étudiées, y compris la réparation bord à bord des feuillets avec des dispositifs, qui ont démontré une sécurité et une efficacité favorables pour réduire la gravité de la TR de deux degrés ou plus chez la plupart des patients. Les questions importantes à aborder dans les études futures comprennent le moment optimal de l’intervention, la combinaison idéale de divers dispositifs avec une anatomie spécifique, ainsi que les avantages et la durabilité à long terme de ces traitements.
| Fuite paravalvulaire : étendue du problème et prise en charge interventionnelle |
La fuite paravalvulaire (PVL) est une affection qui compromet les valvules prothétiques et se caractérise par une régurgitation du sang autour de la prothèse.
Dans les valves prothétiques chirurgicales, la PVL peut être due à la friabilité des tissus dans des conditions telles que l’endocardite et l’utilisation de stéroïdes, ou à une calcification annulaire. Le PVL affecte 2 à 10 % des valvules aortiques prothétiques et 7 à 17 % des valvules mitrales prothétiques. Dans TAVI, les taux de PVL ont considérablement diminué au cours des 10 dernières années en raison des améliorations apportées à la technologie des appareils et aux techniques de dimensionnement basées sur la tomodensitométrie.
Une PVL modérée ou sévère peut entraîner des symptômes d’insuffisance cardiaque, tandis que tout degré de PVL peut conduire à une anémie hémolytique en raison de dommages mécaniques aux globules rouges dus aux forces de cisaillement. Les lignes directrices de l’AHA/ACC sur les valvulopathies recommandent la fermeture percutanée du PVL pour les patients présentant des symptômes attribuables, une anatomie adéquate et un risque élevé de chirurgie cardiaque.
| Directions futures |
Malgré des progrès extraordinaires dans le traitement des valvulopathies cardiaques, un grand nombre de questions et de lacunes thérapeutiques demeurent.
Les essais cliniques en cours fourniront des preuves importantes pour éclairer les questions sur (a) l’intervention précoce pour la SA modérée et la SA sévère asymptomatique, (b) l’implantation de la valvule mitrale par cathéter chez les patients présentant une régurgitation mitrale ainsi que chez ceux atteints de maladies calcifiantes de la valvule mitrale, (c) stratégies d’anticoagulation dans les valvulopathies cardiaques, et (d) intervention par cathéter chez les patients atteints de TR sévère.
Des essais préliminaires de nouveaux dispositifs de réparation et de remplacement de valves transcathéter pour tester la sécurité et l’efficacité sont encore nécessaires pour répondre à la population croissante de patients atteints de valvulopathies graves. De futures études sont également nécessaires pour mieux comprendre la physiopathologie de la valvulopathie calcifiée et explorer la faisabilité de l’ingénierie tissulaire dans le développement de nouvelles valvules cardiaques prothétiques, ainsi que le rôle de l’intelligence artificielle dans la détection et le calendrier du traitement de la valvulopathie. .