La malattia della valvola cardiaca è una delle principali fonti di morbilità e mortalità cardiovascolare in tutto il mondo.
Tra i molti progressi recenti figurano ( a ) un maggiore riconoscimento dell’impatto della fibrillazione atriale (FA) sullo sviluppo e sulla valutazione della malattia valvolare, ( b ) nuove strategie per la prevenzione globale della cardiopatia reumatica (RC), ( c ) miglioramenti comprensione e trattamento del rigurgito mitralico secondario (SMI), ( d ) una classificazione aggiornata della malattia della valvola aortica bicuspide (BAV) e ( e ) riconoscimento dell’aumento del rischio cardiovascolare associato alla stenosi aortica (AS) moderata.
Inoltre, con l’invecchiamento della popolazione e l’epidemia emergente di cardiopatia valvolare degenerativa e funzionale, stanno diventando disponibili più terapie transcatetere che vengono attivamente studiate attraverso rigorosi studi clinici. Questa revisione fornisce un aggiornamento su questi argomenti con un focus sulle prove recenti e sulle direzioni future.
| Cambiamenti globali nell’epidemiologia della malattia della valvola cardiaca |
fibrillazione atriale
Un cuore in cui si verifica la fibrillazione atriale è fenotipicamente caratterizzato da atri più grandi, aumento della resistenza vascolare polmonare, insufficienza cardiaca destra, diminuzione del flusso in avanti, diminuzione della riserva di gittata cardiaca e aumento del contenimento pericardico, tutti fattori che contribuiscono a esiti avversi.
La fibrillazione atriale condivide comuni fattori di rischio cardiovascolare implicati nella malattia valvolare degenerativa, inclusi, ma non limitati a, età avanzata, ipertensione, diabete e iperlipidemia. Pertanto, la prevalenza della fibrillazione atriale nella malattia valvolare reumatica o non reumatica è molto elevata, soprattutto tra i soggetti con malattia valvolare da moderata a grave.
Le complicanze della coesistenza di fibrillazione atriale nei pazienti con malattia valvolare comprendono un aumento del rischio di ictus ed embolizzazione sistemica, nonché un aumento del rischio di mortalità cardiovascolare e per tutte le cause.
Cardiopatia reumatica: prevenzione e trattamento
La CR è una conseguenza della febbre reumatica (RF) causata da un’infezione da streptococco di gruppo A. I fattori di rischio per le infezioni da streptococco di gruppo A ad alta incidenza comprendono la povertà e l’accesso limitato all’assistenza sanitaria. I miglioramenti nello stato socioeconomico e nell’accesso a un’assistenza sanitaria adeguata, che riducono il rischio di trasmissione e infezione da streptococchi di gruppo A, così come il riconoscimento e il trattamento precoce e tempestivo di tali infezioni, riducono sostanzialmente l’incidenza della RF e rappresentano la pietra angolare dell’assistenza primaria .
La prevenzione secondaria, mirata a prevenire la recidiva di RF e la progressione della CR stabilita, viene ottenuta con la benzatina penicillina G somministrata per via intramuscolare ogni 3 o 4 settimane, ma l’accesso a questo farmaco è stato molto difficile nelle aree endemiche, in parte a causa della ridotta disponibilità di il farmaco. La valvoplastica mitralica con palloncino e la riparazione/sostituzione della valvola sono necessarie per la CR grave sintomatica, ma anche per questi interventi le risorse sono scarse laddove RF e CR sono endemiche.
La stenosi mitralica reumatica è la malattia valvolare sottostante più comune nei pazienti dei paesi a basso e medio reddito che presentano fibrillazione atriale.
Vi è un intenso e rinnovato impegno da parte dell’Organizzazione Mondiale della Sanità, della World Heart Federation e dell’American Heart Association, tra le altre organizzazioni internazionali e globali, per prevenire e controllare la RF e la CR, data la persistenza di queste malattie. nei paesi a basso e medio reddito.
| Rigurgito mitralico secondario: fisiopatologia e gestione |
Tradizionalmente, l’MSI è stata considerata una malattia del ventricolo sinistro (LV), con anomalie del movimento della parete regionale che portano al blocco del movimento dei lembi e alla coaptazione incompleta in pazienti con lembi della valvola mitrale normali o quasi normali. ( Figura 1 ). La situazione, tuttavia, è più complessa a causa dell’eterogeneità dell’IMS.
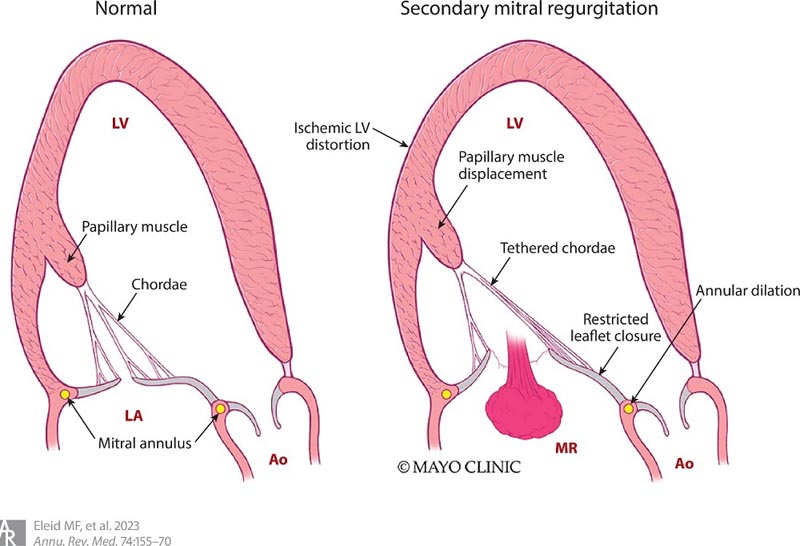
Figura 1 . La fisiopatologia e i meccanismi del rigurgito mitralico secondario comprendono la dilatazione del ventricolo sinistro con conseguente spostamento del muscolo papillare, l’ancoraggio delle corde e la chiusura limitata dei lembi, nonché l’allargamento dell’atrio sinistro e dell’anulus mitralico. Abbreviazioni: Ao, aorta; LA, atrio sinistro; VI, ventricolo sinistro; RM: insufficienza della valvola mitrale.
A un’estremità dello spettro si trova l’MSI con dilatazione del ventricolo sinistro che porta a una distorsione globale della funzione dell’apparato valvolare mitralico e, in particolare, a una dilatazione anulare. In questa situazione, il rigurgito mitralico è essenzialmente uno spettatore e l’obiettivo primario del trattamento è affrontare la disfunzione del ventricolo sinistro e ridurne le dimensioni. Al contrario, i processi patologici che colpiscono il miocardio ventricolare possono coinvolgere in modo sproporzionato i segmenti di supporto dell’apparato valvolare mitralico causando l’immobilizzazione dei lembi e il conseguente ispessimento e disfunzione.
Da un punto di vista terapeutico, ci sono diverse questioni da affrontare. Poiché la disfunzione del ventricolo sinistro (sia globale che regionale) è una componente integrale dell’MSI, dovrebbe essere affrontata utilizzando approcci farmacologici determinati dalle linee guida e forse una terapia di resincronizzazione cardiaca in pazienti altamente selezionati.
Nei pazienti con malattia coronarica, la rivascolarizzazione da sola ha avuto un effetto incoerente sulla gravità dell’insufficienza mitralica. Il problema nei pazienti con IMS sottoposti a bypass aortocoronarico (CABG) è più sfumato; Non è stato completamente deciso se sia necessario eseguire il solo CABG o il CABG con riparazione o sostituzione della valvola mitrale, in particolare nei pazienti senza sintomi di insufficienza cardiaca.
Per i pazienti sottoposti a CABG in cui l’MSI è presente ma non è considerato la causa dei sintomi, le opzioni includono il solo CABG, il CABG più riparazione o preferibilmente sostituzione della valvola mitrale, o il solo CABG seguito da un’attenta osservazione con l’opzione di una procedura percutanea.
Nei pazienti con MSI sintomatico, è importante considerare se i sintomi sono secondari alla congestione (cioè dispnea) o forse secondari alla bassa gittata cardiaca (affaticamento) come conseguenza della gravità della disfunzione ventricolare sinistra, del rimodellamento e della cicatrizzazione. e se il grado di IM è proporzionale o sproporzionato rispetto al grado di
Dilatazione del ventricolo sinistro ( figura 2 ). Ciò che è certo è che il trattamento percutaneo e chirurgico delle MSI si sta evolvendo ed è attualmente al centro di un arsenale tecnologico in rapida espansione.
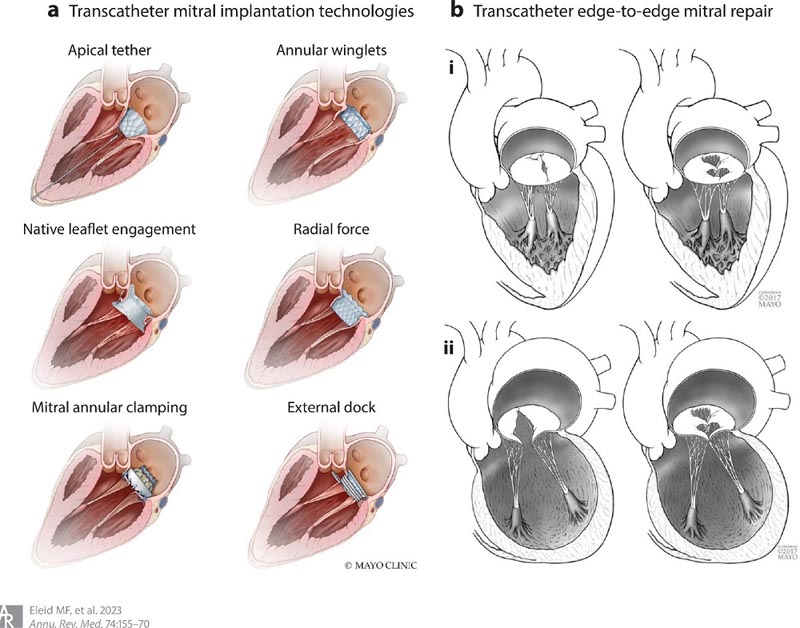
Figura 2 . (a) Dispositivi per l’impianto percutaneo della valvola mitrale e rispettivi meccanismi di ancoraggio. (b) Riparazione transcatetere da bordo a bordo della valvola mitrale nel rigurgito mitralico primario (i) e secondario (ii).
L’associazione eziologica tra fibrillazione atriale/flutter e rigurgito mitralico non è in discussione. Tuttavia, ciò che non sappiamo è quale percentuale di pazienti con fibrillazione atriale/flutter incidente e senza preesistente malattia valvolare cardiaca al momento della diagnosi svilupperà anomalie valvolari significative. La questione è oggetto di studi in corso, che dovrebbero aiutare a chiarire la portata del problema.
| Approcci interventistici per la malattia della valvola mitrale |
L’insufficienza mitralica si divide in eziologie primarie e secondarie, che sono molto importanti per decidere il trattamento ottimale.
La malattia della valvola mitrale primaria comprende eziologie degenerative come il deficit fibroelastico e il prolasso della valvola mitrale, che si riscontrano più comunemente nei paesi ad alto reddito, mentre la malattia reumatica della valvola mitrale è più comune nei paesi a basso e medio reddito. L’endocardite e la malattia calcifica della valvola mitrale sono altre importanti cause di malattia della valvola mitrale primaria.
La riparazione chirurgica della valvola mitrale è l’intervento di scelta per i pazienti con insufficienza mitralica primaria grave che hanno un’adeguata anatomia della valvola mitrale. Tuttavia, molti pazienti non hanno un’anatomia adeguata per la riparazione o corrono un rischio maggiore di mortalità dovuta a chirurgia cardiaca a causa dell’età, delle comorbidità o dei problemi tecnici. Per questi pazienti, un numero crescente di terapie transcatetere viene utilizzato per affrontare un’ampia gamma di malattie della valvola mitrale.
L’impianto transcatetere della valvola mitrale è una nuova strategia di trattamento minimamente invasiva per i pazienti con grave malattia della valvola mitrale ad alto rischio di intervento chirurgico, nonché per i pazienti con stenosi mitralica calcifica dovuta alla calcificazione dell’anulus mitralico. L’impianto transettale di valvole espandibili con palloncino transcatetere per pazienti con bioprotesi mitralica degenerata dopo il perfezionamento iniziale della procedura è diventata una procedura sicura ed efficace approvata dalla Food and Drug Administration (FDA) statunitense.
| Stenosi aortica: sottogruppi emodinamici e nuove indicazioni terapeutiche |
Impianto di valvola aortica transcatetere
Dall’iniziale procedura umana avvenuta 20 anni fa, l’impianto transcatetere della valvola aortica (TAVI) ha subito uno sviluppo ricco e rigoroso attraverso la collaborazione interdisciplinare e studi clinici randomizzati fino a diventare una terapia comune e altamente efficace. Gli studi iniziali sulla TAVI in pazienti ad alto o proibitivo rischio di intervento chirurgico hanno stabilito la fattibilità della procedura ma hanno identificato aree di miglioramento, tra cui la perdita paravalvolare (PVL) e il rischio di complicanze vascolari.
Queste complicazioni sono ora rare con la TAVI grazie ai miglioramenti nella tecnologia dei dispositivi, nella tecnica procedurale, nella pianificazione basata sulla TC e nella selezione dei pazienti. La TAVI è ora una terapia di prima linea per i pazienti con AS a rischio intermedio o elevato di sostituzione chirurgica della valvola aortica
La TAVI è attualmente raccomandata come indicazione di classe I nelle recenti linee guida sulla malattia valvolare cardiaca dell’American Heart Association e dell’American College of Cardiology per i pazienti con AS che sono a basso rischio per la sostituzione chirurgica della valvola aortica e sono candidati idonei per la protesi biologica con un aspettativa di vita di 20 anni. anni o meno
Stenosi aortica moderata
Dati recenti nella pratica contemporanea suggeriscono una prognosi sfavorevole nei pazienti con AD moderata; Alcuni dati suggeriscono una mortalità altrettanto elevata associata all’AD moderato e grave quando non trattato, ma non è chiaro se l’aumento della mortalità fosse correlato alle comorbidità.
L’aumento della mortalità è stato associato a riduzione della LVEF (<50%), disfunzione diastolica, insufficienza cardiaca clinica, ceppo globale anormale del ventricolo sinistro e aumento del pro - peptide natriuretico di tipo b N-terminale . Sono in corso studi clinici che esaminano la TAVI rispetto al trattamento medico indicato dalle linee guida in pazienti con SA moderata sintomatica.
Stenosi aortica a basso gradiente
I determinanti fondamentali del gradiente medio attraverso la valvola aortica sono l’area e il flusso diretto. Una piccola area della valvola aortica (≤1 cm2), associata a un basso gradiente (<40 mm Hg) e una velocità di picco (<4 m/sec), definisce una stenosi aortica a basso gradiente (LGAS). L’LGAS si verifica tipicamente come risultato di un basso flusso diretto, presupponendo l’assenza di errori di misurazione, o di un elevato postcarico transvalvolare (cioè ipertensione sistemica). Qualsiasi condizione che si traduce in un flusso diretto basso può risultare in LGAS. Il trattamento dell’ipertensione sistemica nella LGAS è associato ad una riduzione delle pressioni di riempimento del ventricolo sinistro e ad un aumento del flusso in avanti ed è raccomandato come un passo importante nel trattamento.
Valvola aortica bicuspide
La malattia BAV è la cardiopatia congenita più comune e colpisce l’1-2% della popolazione generale. I determinanti genetici della malattia BAV contribuiscono anche all’aortopatia, presente nel 50% dei pazienti con malattia BAV e caratterizzata da ridotta integrità strutturale ed elasticità della parete aortica.
Anche le dinamiche anomale del flusso attraverso un BAV, specialmente se associate a stenosi progressiva o rigurgito, contribuiscono alla dilatazione aortica. I fenotipi più comuni sono la fusione delle cuspidi coronariche destra e sinistra, seguita dalla fusione delle cuspidi destra e non coronarica.
| Rigurgito della valvola tricuspide |
Momento dell’intervento
Le attuali linee guida raccomandano l’intervento della valvola tricuspide nel rigurgito tricuspide primario (TR) quando sono presenti sintomi o quando c’è almeno una dilatazione progressiva del ventricolo destro (RV) o una disfunzione sistolica, o quando c’è un TR significativo o una dilatazione anulare. tricuspide durante un intervento chirurgico a cuore aperto per una malattia del cuore sinistro.
La TR rimane in gran parte sottotrattata e la recente tendenza leggermente al rialzo della chirurgia della valvola tricuspide per la TR, in particolare la riparazione, è stata associata anche all’età dei pazienti più anziani e alle comorbilità al momento dell’intervento. Misurazioni quantitative più precise delle dimensioni del ventricolo destro e della funzione sistolica (ad esempio, ecocardiografia 3D o risonanza magnetica cardiaca) e l’identificazione di fattori scatenanti precoci per la chirurgia della valvola tricuspide sono attualmente oggetto di studio attivo per migliorare i risultati.
Approcci interventistici transcateteri per la tricuspide
Solo il 10% dei pazienti con TR sintomatica grave viene sottoposto a trattamento chirurgico, mentre la maggioranza viene trattata con la sola terapia diuretica. Dato l’impatto negativo di un TR grave sia sulla qualità della vita che sulla sopravvivenza, e il grado estremo di TR osservato in un’ampia percentuale di pazienti, vi è una grande necessità di terapie transcatetere minimamente invasive.
Sono allo studio numerose terapie transcatetere, inclusa la riparazione dei lembi da bordo a bordo con dispositivi, che hanno dimostrato sicurezza ed efficacia favorevoli nel ridurre la gravità della TR di due o più gradi nella maggior parte dei pazienti. Domande importanti da affrontare negli studi futuri includono la tempistica ottimale dell’intervento, la combinazione ideale di vari dispositivi con un’anatomia specifica e il beneficio a lungo termine e la durata di questi trattamenti.
| Perdita paravalvolare: portata del problema e gestione interventistica |
La perdita paravalvolare (PVL) è una condizione che compromette le valvole protesiche ed è caratterizzata dal rigurgito di sangue attorno alla protesi.
Nelle valvole protesiche chirurgiche, la PVL può essere dovuta alla friabilità dei tessuti in condizioni come l’endocardite e l’uso di steroidi, o alla calcificazione dell’anulare. La PVL colpisce dal 2% al 10% delle valvole aortiche protesiche e dal 7% al 17% delle valvole mitraliche protesiche. Nella TAVI, i tassi di PVL sono diminuiti drasticamente negli ultimi 10 anni a causa dei miglioramenti nella tecnologia dei dispositivi e nelle tecniche di dimensionamento basate sulla TC.
Il PVL moderato o grave può portare a sintomi di insufficienza cardiaca, mentre qualsiasi grado di PVL può portare ad anemia emolitica a causa del danno meccanico ai globuli rossi attraverso le forze di taglio. Le linee guida AHA/ACC sulle cardiopatie valvolari raccomandano la chiusura percutanea del PVL per i pazienti che presentano sintomi attribuibili, un’anatomia adeguata e un alto rischio di intervento di chirurgia cardiaca.
| Direzioni future |
Nonostante gli straordinari progressi nel trattamento della cardiopatia valvolare, permangono numerosi interrogativi e lacune terapeutiche.
Gli studi clinici in corso forniranno prove importanti per rispondere a domande su (a) intervento precoce per la SA moderata e la SA grave asintomatica, (b) impianto transcatetere della valvola mitrale in pazienti con rigurgito mitralico così come in quelli con malattie calcifiche della valvola mitrale, (c) strategie anticoagulanti nella malattia valvolare cardiaca e (d) intervento transcatetere in pazienti con TR grave.
Sono ancora necessari studi in fase iniziale di nuovi dispositivi di riparazione e sostituzione della valvola transcatetere per testarne la sicurezza e l’efficacia per affrontare la crescente popolazione di pazienti con grave malattia valvolare. Sono inoltre necessari studi futuri per comprendere meglio la fisiopatologia della malattia valvolare calcifica ed esplorare la fattibilità dell’ingegneria tissutale nello sviluppo di nuove valvole cardiache protesiche, il ruolo dell’intelligenza artificiale nel rilevamento e la tempistica del trattamento della malattia valvolare. .