Points forts
|
Résumé
Le stress psychosocial a un impact profond sur le bien-être et la santé. La réponse au stress est principalement associée à l’amygdale, une structure cruciale du système de défense contre la peur, essentielle à la cognition sociale et à la régulation des émotions. Des études récentes de neuroimagerie ont démontré comment une activité métabolique accrue de l’amygdale augmente l’inflammation et conduit à une maladie cardiométabolique.
Le développement de stratégies thérapeutiques dépend de notre compréhension des facteurs qui activent le système de défense contre la peur et des mécanismes moléculaires en aval qui traduisent le stress émotionnel en dommages cellulaires. La peur des émotions résultant d’un traumatisme d’attachement est le déclencheur le plus important de l’ activation inadaptée du système de défense contre la peur. Les voies moléculaires centrales sont l’amélioration de la myélopoïèse et la régulation positive de l’expression des gènes proinflammatoires, la résistance aux glucocorticoïdes et à l’insuline et le stress oxydatif.
Les stratégies thérapeutiques peuvent bénéficier d’approches holistiques. La psychothérapie peut réduire l’activation inadaptée et accrue du système de défense contre la peur. Les interventions biologiques peuvent atténuer les effets néfastes du stress oxydatif sur l’organisme.
Il est devenu courant que le stress mental soit nocif pour la santé et on sait que les personnes souffrant de troubles mentaux ont un risque accru de développer des maladies cardiométaboliques et une espérance de vie considérablement réduite. Cette revue montrera que le stress mental est causé par l’activation inadaptée du système de défense contre la peur et mettra en évidence le rôle des émotions, qui constituent le principal système inné de motivation et de régulation chez l’homme, dans ce processus.
- Tout d’abord, nous donnons un aperçu du système de défense contre la peur et du rôle central de l’ amygdale .
- Deuxièmement, nous décrivons comment l’activation du système de défense contre la peur conduit à une inflammation .
- Troisièmement, nous démontrons les déclencheurs les plus importants du système de défense contre la peur.
- Quatrièmement, nous décrivons les voies allant de l’activation de l’amygdale au stress oxydatif .
- Cinquièmement, nous cartographions les implications cliniques et sociales.
L’amygdale et le système de défense contre la peur
Le système de défense contre la peur est un système inné qui organise des réponses défensives typiques de l’espèce, câblées pour répondre aux menaces favorisant la survie. L’activation d’un comportement défensif commence par une réaction d’excitation traitée par l’amygdale qui se produit sans conscience. La perception consciente de cette réaction est une sensation d’anxiété (par exemple, tension musculaire dans le cou, transpiration, accélération du rythme cardiaque, hyperventilation, vasospasme avec mains froides).
Les modèles de réponses défensives peuvent être classés comme suit :
Le combat ou la fuite représentent des réponses actives (chez les humains, par exemple, se mettre en colère et parler ou devenir soumis).
La congélation est un état d’immobilité attentive, qui permet au mammifère de scruter l’environnement et de préparer des réactions de combat ou de fuite (par exemple, état de vigilance renforcée avec corps tendu activé). Dans des situations de menace inéluctable, les mammifères réagissent avec une immobilité tonique . Cette défense terminale a pour fonction de désactiver le réflexe tueur du prédateur lorsque le mammifère a été capturé.
Chez les humains, cette défense se caractérise par des expériences d’engourdissement, de peur, de distorsions perceptuelles telles que la déréalisation et la dépersonnalisation, et de désespoir. Une réponse de défense similaire est l’immobilité effondrée (chez l’homme, par exemple, évanouissement provoqué par la peur en raison d’une hypoxie cérébrale).
La réponse finale est l’immobilité inactive , qui survient après des périodes de stress aigu lorsque le mammifère est revenu dans un environnement sûr et sert à récupérer. Cette réponse défensive est le mécanisme cérébral sous-jacent à des affections cliniques telles que les syndromes de douleur chronique ou l’épuisement prolongé .
Ces réactions de défense ont des voies neurohumorales spécifiques qui incluent l’amygdale, l’hypothalamus, le gris périaqueducal et les noyaux sympathique et vagal.
La maladaptation du système de défense contre la peur et l’anxiété dérégulée constituent les bases psychophysiologiques des troubles mentaux courants.
Déclencheurs du système de défense contre la peur et rôle des émotions
Des stimuli innés ou des menaces externes peuvent déclencher le système de défense contre la peur. Chez l’homme, par exemple, l’exposition au bruit ou à des stimuli auditifs aversifs représente un stimulus naturel qui active l’amygdale.
L’exposition à des facteurs de stress psychosociaux, tels que les zones résidentielles pauvres et à faible revenu, sont des menaces externes omniprésentes qui activent le système de défense contre la peur, avec des effets délétères sur la santé et la survie.
Cependant, chez l’homme, les déclencheurs dépendants de l’expérience revêtent une importance particulière pour l’activation du système de défense contre la peur. Le mécanisme sous-jacent est appelé défense pavlovienne ou conditionnement de la peur : des stimuli insignifiants deviennent des signaux de menace lorsqu’ils surviennent parallèlement à des menaces biologiquement significatives.
Chez l’humain, plus que chez les autres espèces, le développement cérébral est prolongé pour permettre une adaptation optimale grâce à l’acquisition de comportements complexes. Les expériences d’attachement avec les parents jouent un rôle essentiel dans l’acquisition de comportements cognitifs et affectifs complexes et jouent un rôle unique dans le conditionnement de la peur.
Par conséquent, les difficultés précoces des soignants, telles que les abus (physiques, émotionnels, sexuels) ou la négligence des besoins émotionnels du bébé (par exemple, en raison de troubles mentaux parentaux ou de pertes précoces de soignants ou d’adversités sociales) sont des facteurs de stress très puissants pour le développement neurologique.
Ces effets sont particulièrement traités par l’ amygdale et le cortex préfrontal médial (mPFC). Le mPFC est une structure cérébrale importante pour la cognition sociale et la régulation des émotions et du comportement.
Au cours du développement humain, l’amygdale et le mPFC forment de riches interconnexions. En effet, les expériences d’attachement sécurisé pendant la petite enfance sont associées à une maturation plus adaptative de la connectivité amygdale-mPFC et à des volumes d’amygdale plus petits par rapport aux expériences d’attachement non sécurisées.
Le traumatisme de l’attachement prédit un plus grand volume d’amygdale à l’âge adulte et entraîne une plus grande réponse de l’amygdale aux stimuli saillants. Dans ce contexte, il est essentiel de reconnaître que la relation d’attachement entre les bébés et les parents est régulée par des émotions fondamentales, telles que le bonheur, la tristesse, la colère, le dégoût, la surprise et la peur.
Les émotions sont le principal système de motivation des humains.
Les bébés, incapables de parler, communiquent avec leurs parents par l’expression de leurs sentiments. Les émotions sont des régulateurs intra et interpersonnels. La colère, par exemple, initie des types de comportements d’affirmation de soi du bébé envers le parent . Les réponses adaptatives des parents envers le nourrisson en colère augmenteront son efficacité personnelle et sa confiance dans la figure d’attachement.
Cependant, la réaction du parent peut également entraîner un conditionnement de peur de l’émotion « colère » . Imaginez que le parent réagisse avec anxiété ou effraie le nourrisson en devenant agressif ou en se retirant, alors l’émotion de colère devient un signal de menace pour le nourrisson.
En raison de l’immense dépendance à l’égard de la figure d’attachement, la motivation la plus cruciale du bébé est de maintenir le lien avec le père et d’éviter tout comportement qui pourrait mettre en péril le lien avec le père. Les troubles mentaux sont le résultat de telles phobies affectives apprises et de l’évitement ou de la défense de telles émotions à l’âge adulte.
Comme les émotions constituent le système de motivation de base des humains, la peur conditionnée des émotions et la défense contre les sentiments ont un impact profond sur le développement de l’identité, l’autorégulation et les compétences interpersonnelles.
Un marqueur crucial de la santé mentale est donc la capacité à ressentir et à exprimer toute la gamme des émotions de manière adaptative.
Il est important de noter que de nombreux comportements malsains, par exemple fumer, sont un moyen de faire face à une mauvaise adaptation en activant le système de défense contre la peur.
Activation et inflammation de l’amygdale
Des études d’imagerie récentes ont démontré, pour la première fois, comment l’activation du système de défense contre la peur basé sur l’amygdale conduit à des maladies somatiques.
Dans la première étude, Tawakol et al. (2017) ont démontré, à l’aide de la tomographie par émission de positons au 18F-fluorodésoxyglucose, qu’une activité métabolique accrue de l’amygdale prédisait le développement indépendant et robuste de l’athérosclérose et des maladies cardiovasculaires .
L’activité métabolique amygdalienne était en outre corrélée au niveau de stress autodéclaré, et le stress perçu était associé aux mesures de l’inflammation. Augmentation de l’activité métabolique des amygdales induite par les voies du système nerveux sympathique, l’activation de la moelle osseuse et donc une libération accrue de cellules inflammatoires en raison d’une inflammation vasculaire accrue.
Les mêmes voies ont été élucidées chez un échantillon de patients atteints de psoriasis , une maladie cutanée inflammatoire chronique : une activité métabolique accrue de l’amygdale a conduit à une activation du système hématopoïétique avec une libération accrue de monocytes activés qui stimulent l’inflammation et l’athérosclérose.
D’autres études de neuroimagerie ont montré que l’activité de l’amygdale était associée à une adiposité viscérale basale , ainsi qu’à une augmentation de l’adiposité viscérale et au développement d’ un diabète sucré indépendant de l’adiposité. Encore une fois, ces effets néfastes sur la santé étaient principalement médiés par une augmentation de la leucopoïèse proinflammatoire induite par l’activation du système de défense contre la peur.
Activation de l’amygdale et stress oxydatif
La cascade neurochimique induite par l’activation inadaptée du système de défense contre la peur lié à l’amygdale peut avoir des conséquences à long terme telles qu’une inflammation, l’athérosclérose, des modifications de la sensibilité à l’insuline et des maladies cardiovasculaires. L’activation chronique de l’amygdale entraîne l’activation du système nerveux sympathique (SNS) et de l’axe hypothalamo-hypophyso-surrénalien (HPA) (Fig. 1).
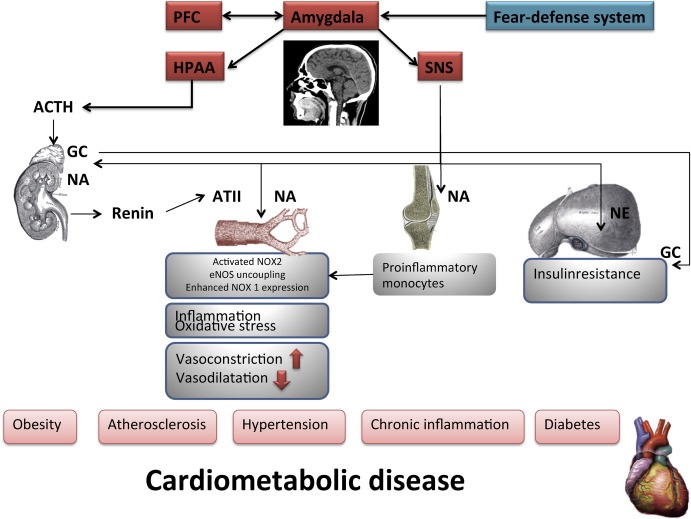 Figure 1. L’activation chronique de l’amygdale entraîne l’activation de l’axe hypothalamo-hypophyso-surrénalien (HPA), ainsi que l’activation du système nerveux sympathique (SNS). L’activation du SNS conduit à la sécrétion de rénine et à la libération d’angiotensine II (ATII). L’ATII active NOX2 (NADPH oxydase 2) dans les cellules endothéliales, entraînant un stress oxydatif. Cela peut conduire au découplage de l’oxyde nitrique synthétase endothélial (eNOS). Le stress oxydatif dans les cellules endothéliales active le NF-kB (amplificateur de chaîne légère k du facteur nucléaire des cellules B activées), conduisant à l’induction de molécules d’adhésion conduisant à une inflammation vasculaire. L’axe HPA est médié par le CRF (corticotropin-releasing factor), l’ACTH (hormone adrénocorticotrope) et les corticostéroïdes. Lorsqu’il est stimulé, l’axe HPA libère rapidement des glucocorticoïdes (GC). La GC améliore l’expression de NOX1 (NADPH oxydase 1) dans les cellules musculaires vasculaires. GC et NA (norépinéphrine) peuvent entraîner une diminution de la sensibilité à l’insuline. Le schéma a été en partie adopté par Li et al. Fr. J Pharmacol. 2019 (Li, Kigallen et Münzel, 2019).
Figure 1. L’activation chronique de l’amygdale entraîne l’activation de l’axe hypothalamo-hypophyso-surrénalien (HPA), ainsi que l’activation du système nerveux sympathique (SNS). L’activation du SNS conduit à la sécrétion de rénine et à la libération d’angiotensine II (ATII). L’ATII active NOX2 (NADPH oxydase 2) dans les cellules endothéliales, entraînant un stress oxydatif. Cela peut conduire au découplage de l’oxyde nitrique synthétase endothélial (eNOS). Le stress oxydatif dans les cellules endothéliales active le NF-kB (amplificateur de chaîne légère k du facteur nucléaire des cellules B activées), conduisant à l’induction de molécules d’adhésion conduisant à une inflammation vasculaire. L’axe HPA est médié par le CRF (corticotropin-releasing factor), l’ACTH (hormone adrénocorticotrope) et les corticostéroïdes. Lorsqu’il est stimulé, l’axe HPA libère rapidement des glucocorticoïdes (GC). La GC améliore l’expression de NOX1 (NADPH oxydase 1) dans les cellules musculaires vasculaires. GC et NA (norépinéphrine) peuvent entraîner une diminution de la sensibilité à l’insuline. Le schéma a été en partie adopté par Li et al. Fr. J Pharmacol. 2019 (Li, Kigallen et Münzel, 2019).
Le système nerveux sympathique, le stress oxydatif et les monocytes proinflammatoires
Activation du SNS dans la libération rapide d’adrénaline et de noradrénaline, principalement par la médullosurrénale. Le SNS stimule la sécrétion de rénine et la production d’angiotensine II (ATII). La NADPH oxydase (NOX2) dans les cellules endothéliales est activée par l’ATII, entraînant un stress oxydatif.
Le terme stress oxydatif est communément défini comme un excès de facteurs pro-oxydants, d’espèces réactives de l’oxygène (ROS) et d’espèces réactives de l’azote (RNS) par rapport aux antioxydants. Des concentrations élevées de ROS et de RNS et une faible capacité antioxydante peuvent endommager divers composants cellulaires. La conséquence est une détresse cellulaire grave avec une fonction cellulaire altérée et la mort cellulaire.
NOX2 activé peut induire un découplage de l’oxydase nitrique endothéliale (eNOS). Le découplage de l’eNOS conduit à une production réduite de NO. De plus, la norépinéphrine améliore l’expression des NOX et favorise l’adhésion des cellules immunitaires à la paroi vasculaire. L’infiltration de cellules immunitaires provoque un stress oxydatif vasculaire via l’activité NOX2.
De plus, la signalisation ROS active les facteurs de transcription, conduisant à l’expression de plusieurs gènes impliqués dans l’action suppressive des tumeurs et antioxydante. Par exemple, la signalisation ROS peut améliorer l’expression du facteur nucléaire kappa B (NF-κB) (33). NF-κB régule l’expression de près de 500 gènes différents, y compris des enzymes, par exemple la NO synthase inductible (iNOS), les cytokines et le facteur de nécrose tumorale (TNF) (59).
NF-κB peut être activé de manière transitoire par divers stimuli, comme une exposition aiguë à l’alcool, à la fumée de cigarette, au stress physiologique, mais aussi par un stress mental qui produit des réponses neuroinflammatoires chez la souris [1,69], qui représente un « capteur de stress » .
L’activation du SNS améliore la monocytopoïèse dans la moelle osseuse, entraînant l’expansion des monocytes pro-inflammatoires . De plus, l’inflammation chronique entraîne une modification de la topographie hématopoïétique de la moelle osseuse vers la rate. La migration des cellules progénitrices hématopoïétiques de la moelle osseuse vers la périphérie contribue à augmenter la production de leucocytes.
Les données accumulées suggèrent que le stress psychosocial et un mode de vie malsain déclenchent le déplacement des cellules souches hématopoïétiques et la libération de progéniteurs de la moelle osseuse vers la périphérie.
En outre, l’augmentation de l’activité du système nerveux sympathique a diminué l’expression de la chimiokine CXC 12 (CXCL12) dans la niche des cellules souches hématopoïétiques et a augmenté la production de neutrophiles et de monocytes chez les souris exposées au stress. Cela a conduit à une libération importante de leucocytes inflammatoires dans la circulation et a favorisé l’inflammation de la plaque athéroscléreuse.
L’axe HPA et les glucocorticoïdes
La cascade de l’axe HPA est très efficace pour maintenir l’allostasie et l’adaptation aux stimuli stressants.
Dans la dépression , l’activité de l’axe HPA est associée à une hypercortisolémie et à une réduction du feedback inhibiteur. Chez les individus solitaires , l’activation de l’axe HPA est un constat constant. L’axe HPA est médié par le facteur de libération de la corticotropine (CRF) et l’hormone adrénocorticotrope (ACTH). Lorsqu’il est stimulé, l’axe HPA libère rapidement des concentrations élevées d’hormones de stress glucocorticoïdes, entraînant une augmentation du métabolisme cellulaire et la formation spontanée de radicaux oxygène et azotés.
La libération de glucocorticoïdes suit le rythme circadien , avec les niveaux les plus élevés le matin et les niveaux les plus bas le soir. Les glucocorticoïdes régissent les fonctions physiologiques, notamment l’immunité, la sensibilité à l’insuline , l’activité cardiovasculaire, les processus de reproduction, la neurodégénérescence et l’apoptose.
Le maintien à long terme d’un état défensif inadapté peut conduire à une hypersécrétion de glucocorticoïdes et à une dérégulation de la fonction du récepteur des glucocorticoïdes (GR), notamment une dégradation des GR, une perturbation de la translocation des GR, la liaison de l’ADN-GR et des modifications de l’état de phosphorylation des GR. Des découvertes antérieures suggèrent que les récepteurs glucocorticoïdes peuvent se déplacer dans les mitochondries et moduler l’expression des gènes mitochondriaux.
La résistance aux glucocorticoïdes peut être potentialisée par les cytokines inflammatoires. La régulation de la fonction mitochondriale par la corticostérone est associée à la neuroprotection . Un traitement à faibles doses de corticostérone a eu un effet neuroprotecteur. Le traitement à fortes doses de corticostérone s’est révélé toxique pour les neurones corticaux. La régulation de la fonction neuronale mitochondriale par les stéroïdes est également liée à la neuroprotection et à la plasticité synaptique.
La libération de CRF endogène peut être mesurée dans l’amygdale lors d’un stress. De puissantes actions anxiolytiques sont observées lorsque des antagonistes des récepteurs CRF sont administrés à l’amygdale. Les neurones amygdaliens contenant le CRF peuvent être directement modulés par des altérations des glucocorticoïdes circulants via les récepteurs glucocorticoïdes, qui sont exprimés dans les neurones amygdaloïdes contenant le CRF.
Les troubles mentaux sont associés au stress oxydatif
Les troubles mentaux sont associés à une inflammation accrue.
Cette relation a été démontrée pour les troubles anxieux (trouble de stress post-traumatique, trouble anxiété généralisée, trouble panique et troubles phobiques), les troubles à symptômes somatiques, et particulièrement pour la dépression majeure . Chez les patients déprimés, l’inflammation est associée à des changements neurochimiques, neuroendocriniens et comportementaux.
Les processus inflammatoires augmentent la production de ROS et de RNS ainsi que le stress oxydatif à la fois en périphérie et dans le système nerveux central. Les troubles dépressifs sont associés à des biomarqueurs d’augmentation du stress oxydatif. Le stress oxydatif provoque un vieillissement prématuré, comme en témoigne le raccourcissement des télomères chez les patients souffrant de dépression majeure, et joue un rôle dans l’apparition et l’évolution de la dépression.
Il a été observé que NOX2, en tant que source essentielle de stress oxydatif, est associé à un stress vital grave. De plus, il existe une corrélation négative entre la dépression et le statut antioxydant. Des effets de type antidépresseur peuvent être induits en réduisant les niveaux de NO ou en bloquant la synthèse de NO dans le cerveau.
Chez les patients souffrant de trouble dépressif majeur, un traitement à long terme avec des antidépresseurs a eu des effets positifs sur les dommages oxydatifs et le profil inflammatoire, ainsi que sur les activités des enzymes antioxydantes.
La psychothérapie peut également moduler le stress oxydatif chez les patients souffrant de dépression majeure . Le traitement a réduit les niveaux basaux d’augmentation du NO sérique à des valeurs proches du groupe témoin sain. De plus, la psychothérapie, grâce à l’étiquetage affectif (exprimer ses sentiments avec des mots), peut réduire l’anxiété.
Dans l’ensemble, l’activation chronique du système de défense contre la peur conduit à l’activation des axes SNS et HPA. Cela conduit à un découplage de l’eNOS, à des modifications de la sensibilité du GC et à une augmentation de la monocytopoïèse dans la moelle osseuse, à une inflammation chronique et à des maladies associées (athérosclérose, obésité, diabète).
Implications cliniques et sociales
À l’échelle de la population, des mesures visant à surmonter les disparités sociales et à accroître la santé et la sécurité des environnements représenteraient des mesures visant à réduire l’anxiété, l’inflammation et le stress oxydatif. D’autres approches basées sur la population comprennent des mesures législatives visant à promouvoir une nutrition antioxydante et un mode de vie physiquement actif, comme le recommandent de récentes lignes directrices.
Au niveau individuel, les interventions pharmacologiques peuvent être potentiellement utiles.
|
Il existe de nombreuses interventions fondées sur des preuves pour améliorer l’adaptabilité du système de défense contre la peur, améliorer la santé émotionnelle et améliorer le mode de vie, allant des soins de santé mentale intensifs à la psychothérapie en passant par la méditation de pleine conscience pour améliorer les soins personnels et la relaxation. .
















