Phase-3-Studie zur epikutanen Immuntherapie bei Kindern mit Erdnussallergie
Hintergrund
Es gibt keine zugelassene Behandlung der Erdnussallergie für Kinder unter 4 Jahren und die Wirksamkeit und Sicherheit einer epikutanen Immuntherapie mit einem Erdnusspflaster bei kleinen Kindern mit Erdnussallergie ist unbekannt.
Methoden
Wir haben diese multizentrische, doppelblinde, randomisierte, placebokontrollierte Phase-3-Studie mit Kindern im Alter von 1 bis 3 Jahren mit Erdnussallergie durchgeführt, die durch eine doppelblinde, placebokontrollierte Nahrungsmittelprovokation bestätigt wurde.
Patienten, die eine Auslösedosis (die zur Auslösung einer allergischen Reaktion erforderliche Dosis) von 300 mg oder weniger Erdnussprotein hatten, wurden im Verhältnis 2:1 einer epikutanen Immuntherapie über ein Erdnusspflaster (Gruppenintervention) oder einer Placebo-Verabreichung zugeteilt täglich für 12 Monate.
Der primäre Endpunkt war das Ansprechen auf die Behandlung, gemessen anhand der Auslösedosis Erdnussprotein nach 12 Monaten. Die Sicherheit wurde anhand des Auftretens unerwünschter Ereignisse während der Anwendung des Erdnusspflasters oder des Placebos beurteilt.
Ergebnisse
Von den 362 randomisierten Patienten schlossen 84,8 % die Studie ab. Das primäre Wirksamkeitsergebnis wurde bei 67,0 % der Kinder in der Interventionsgruppe im Vergleich zu 33,5 % der Kinder in der Placebogruppe beobachtet (Risikounterschied 33,4 Prozentpunkte; Bereich 95 % Konfidenz, 22,4 bis 44,5, P < 0,001).
Unerwünschte Ereignisse , die während der Anwendung der Intervention oder des Placebos auftraten, wurden unabhängig von der Beziehung bei 100 % der Patienten in der Interventionsgruppe und bei 99,2 % in der Placebogruppe beobachtet.
Schwerwiegende unerwünschte Ereignisse traten bei 8,6 % der Patienten in der Interventionsgruppe und 2,5 % der Patienten in der Placebogruppe auf; Anaphylaxie trat bei 7,8 % bzw. 3,4 % auf. Schwerwiegende behandlungsbedingte unerwünschte Ereignisse traten bei 0,4 % der Patienten in der Interventionsgruppe und bei keinem in der Placebogruppe auf.
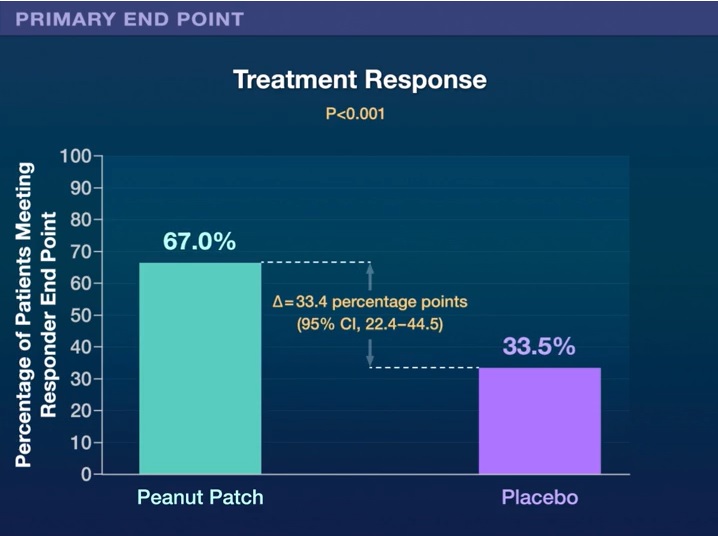
Schlussfolgerungen In dieser Studie mit Kindern im Alter von 1 bis 3 Jahren mit Erdnussallergie war die epikutane Immuntherapie über 12 Monate dem Placebo überlegen, da sie die Kinder gegenüber Erdnüssen desensibilisierte und die Erdnussdosis erhöhte, die allergische Symptome auslöste. |
Kommentare
Eine globale klinische Phase-3-Studie ergab, dass eine einjährige Immuntherapie über ein Hautpflaster Kleinkinder mit Erdnussallergie sicher desensibilisiert und das Risiko einer schweren allergischen Reaktion bei versehentlicher Exposition verringert.
Eine globale klinische Phase-3-Studie mit Beteiligung des Ann & Robert H. Lurie Children’s Hospital of Chicago ergab, dass eine einjährige Immuntherapie über ein Hautpflaster Kleinkinder mit Erdnussallergie sicher desensibilisiert und so das Risiko einer schweren allergischen Reaktion bei versehentlichem Kontakt verringert. Die Ergebnisse dieser von DBV Technologies finanzierten randomisierten, doppelblinden, placebokontrollierten Studie für Kinder im Alter von 1 bis 3 Jahren wurden im New England Journal of Medicine veröffentlicht .
„Wir waren begeistert, zu dieser bahnbrechenden Studie beizutragen, die für unsere jungen Patienten mit Erdnussallergie so vielversprechend ist“, sagte Co-Autorin Dr. Melanie Makhija, leitende Forscherin der Studie am Lurie Children’s und außerordentliche Professorin für Pädiatrie am College of Northwestern University Feinberg Medicine. „Kinder, die ursprünglich auf eine kleine Portion Erdnüsse reagierten, konnten nach Abschluss der Behandlung das Äquivalent von ein bis vier Erdnüssen vertragen. Dies bedeutet, dass diese Kinder gut vor versehentlichem Kontakt mit Erdnüssen geschützt sind. Wichtig ist, dass wir herausgefunden haben, dass „Die Das Erdnusspflaster war sicher und die Wahrscheinlichkeit einer ernsthaften allergischen Reaktion war sehr gering. Das sind hervorragende Neuigkeiten für Familien von Kindern mit Erdnussallergien.“
Eine Erdnussallergie betrifft etwa 2 Prozent der Kinder in den Vereinigten Staaten, Kanada und anderen westlich geprägten Ländern und bleibt häufig bis ins Erwachsenenalter bestehen. Lebensbedrohliche allergische Reaktionen können durch unbeabsichtigte Exposition gegenüber Spuren ausgelöst werden, selbst durch Produkte, die auf gemeinsam genutzten Geräten hergestellt werden, wie z. B. Erdnüsse. Derzeit gibt es keine zugelassenen Behandlungen für Kinder unter 4 Jahren, die gegen Erdnüsse allergisch sind.
Seit 2012 hat das klinische Studienprogramm zu Lebensmittelallergien von Lurie Children Patienten in zahlreiche neuartige Behandlungsstudien aufgenommen, darunter auch die orale Immuntherapie für Erdnüsse, die von der Food and Drug Administration (FDA) zugelassen wurde. Laufende Studien stehen für alle Altersgruppen vom Säuglings- bis zum Erwachsenenalter zur Verfügung. Das Programm wird von den Hauptforscherinnen Elizabeth Lippner, MD, und Abigail Lang, MD, MSCI, geleitet.
Die Forschung am Ann & Robert H. Lurie Children’s Hospital of Chicago wird vom Stanley Manne Children’s Research Institute durchgeführt. Das Manne Research Institute konzentriert sich auf die Verbesserung der Gesundheit von Kindern, die Umgestaltung der Kindermedizin und die Gewährleistung einer gesünderen Zukunft durch das unermüdliche Streben nach Wissen. Lurie Children’s ist eine gemeinnützige Organisation, die sich dafür einsetzt, allen Kindern Zugang zu außergewöhnlicher Betreuung zu ermöglichen. Laut US News & World Report zählt es zu den besten Kinderkrankenhäusern des Landes. Lurie Children’s ist das pädiatrische Ausbildungszentrum der Feinberg School of Medicine der Northwestern University.
Referenz : Phase-3-Studie zur epikutanen Immuntherapie bei Kleinkindern mit Erdnussallergie. New England Journal of Medicine , 2023; 388 (19): 1755 DOI: 10.1056/NEJMoa2212895 Matthew Greenhawt, MD, Sayantani B. Sindher, MD, Julie Wang, MD, Michael O’Sullivan, et al.
(Gefördert von DBV Technologies; EPITOPE ClinicalTrials.gov-Nummer, NCT03211247. Wird in neuem Tab geöffnet.)
















