Studio di fase 3 sull’immunoterapia epicutanea nei bambini con allergia alle arachidi
Sfondo
Non esiste un trattamento approvato per l’allergia alle arachidi per i bambini di età inferiore a 4 anni e l’efficacia e la sicurezza dell’immunoterapia epicutanea con un cerotto alle arachidi nei bambini piccoli con allergia alle arachidi non è nota.
Metodi
Abbiamo condotto questo studio di fase 3, multicentrico, in doppio cieco, randomizzato, controllato con placebo che ha coinvolto bambini da 1 a 3 anni di età con allergia alle arachidi confermata da un test alimentare in doppio cieco, controllato con placebo.
I pazienti a cui era stata somministrata una dose trigger (la dose necessaria per causare una reazione allergica) pari o inferiore a 300 mg di proteine di arachidi sono stati assegnati in un rapporto 2:1 a ricevere un’immunoterapia epicutanea somministrata tramite un cerotto di arachidi (intervento di gruppo) o a ricevere un placebo somministrato ogni giorno per 12 mesi.
L’ endpoint primario era la risposta al trattamento misurata dalla dose trigger di proteine di arachidi a 12 mesi. La sicurezza è stata valutata in base al verificarsi di eventi avversi durante l’uso del cerotto di arachidi o del placebo.
Risultati
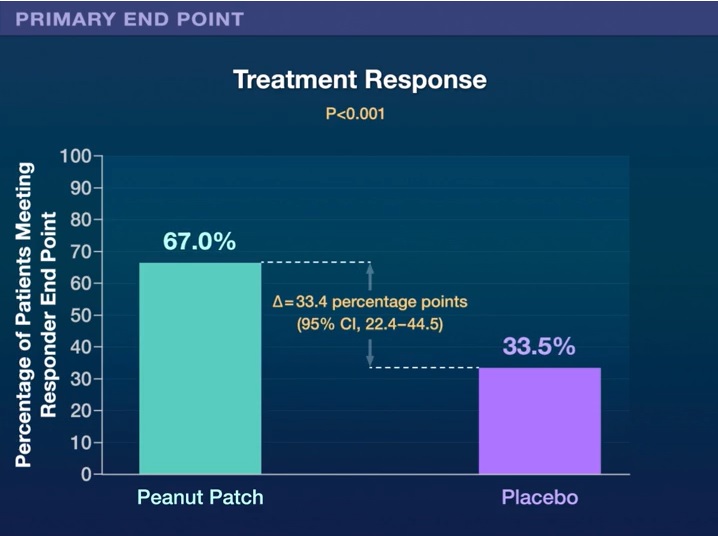
Dei 362 pazienti randomizzati, l’84,8% ha completato lo studio. L’esito primario di efficacia è stato osservato nel 67,0% dei bambini nel gruppo di intervento rispetto al 33,5% di quelli nel gruppo placebo (differenza di rischio, 33,4 punti percentuali; intervallo di confidenza al 95%, da 22,4 a 44,5, P <0,001).
Gli eventi avversi che si sono verificati durante l’utilizzo dell’intervento o del placebo, indipendentemente dalla relazione, sono stati osservati nel 100% dei pazienti nel gruppo di intervento e nel 99,2% nel gruppo placebo.
Eventi avversi gravi si sono verificati nell’8,6% dei pazienti nel gruppo di intervento e nel 2,5% di quelli nel gruppo placebo; l’anafilassi si è verificata rispettivamente nel 7,8% e nel 3,4%. Eventi avversi gravi correlati al trattamento si sono verificati nello 0,4% dei pazienti nel gruppo di intervento e in nessuno nel gruppo placebo.
Conclusioni In questo studio condotto su bambini di età compresa tra 1 e 3 anni con allergia alle arachidi, l’immunoterapia epicutanea per 12 mesi si è rivelata superiore al placebo nel desensibilizzare i bambini alle arachidi e nell’aumentare la dose di arachidi che ha scatenato i sintomi allergici. |
Commenti
Uno studio clinico globale di Fase 3 ha rilevato che un’immunoterapia di un anno tramite cerotto cutaneo ha desensibilizzato in modo sicuro i bambini piccoli con allergia alle arachidi, riducendo il rischio di una grave reazione allergica derivante dall’esposizione accidentale.
Uno studio clinico globale di Fase 3 che ha coinvolto l’Ann & Robert H. Lurie Children’s Hospital di Chicago ha scoperto che un’immunoterapia di un anno tramite cerotto cutaneo desensibilizza in modo sicuro i bambini piccoli con allergia alle arachidi, riducendo il rischio di una grave reazione allergica derivante dall’esposizione accidentale. I risultati di questo studio randomizzato, in doppio cieco, controllato con placebo, condotto su bambini di età compresa tra 1 e 3 anni, finanziato da DBV Technologies, sono stati pubblicati sul New England Journal of Medicine .
"Siamo stati entusiasti di contribuire a questo studio fondamentale che è così promettente per i nostri giovani pazienti allergici alle arachidi", ha affermato la coautrice Melanie Makhija, MD, che è stata la ricercatrice principale dello studio presso Lurie Children’s ed è professoressa associata. di Pediatria presso il College of Northwestern University Feinberg Medicine. "I bambini che inizialmente avevano reagito a una piccola frazione di noccioline erano in grado di tollerare l’equivalente di una o quattro noccioline dopo aver completato il ciclo di trattamento. Ciò significa che questi bambini saranno ben protetti dall’esposizione accidentale alle arachidi. È importante sottolineare che abbiamo scoperto che "La il cerotto di arachidi era sicuro, con pochissime possibilità di una grave reazione allergica. Questa è un’ottima notizia per le famiglie di bambini con allergie alle arachidi."
L’allergia alle arachidi colpisce circa il 2% dei bambini negli Stati Uniti, in Canada e in altri paesi occidentalizzati e comunemente persiste fino all’età adulta. Reazioni allergiche potenzialmente letali possono essere scatenate dall’esposizione involontaria a quantità in tracce, anche attraverso prodotti fabbricati su attrezzature condivise come le arachidi. Attualmente non esistono trattamenti approvati per i bambini sotto i 4 anni di età allergici alle arachidi.
Dal 2012, il programma di studi clinici sulle allergie alimentari di Lurie Children ha arruolato pazienti in numerosi nuovi studi terapeutici, inclusa l’immunoterapia orale per le arachidi che è stata approvata dalla Food and Drug Administration (FDA). Sono disponibili sperimentazioni in corso per tutte le fasce d’età, dall’infanzia all’età adulta. Il programma è condotto dai ricercatori principali Elizabeth Lippner, MD, e Abigail Lang, MD, MSCI.
La ricerca presso l’Ann & Robert H. Lurie Children’s Hospital di Chicago è condotta attraverso lo Stanley Manne Children’s Research Institute. Il Manne Research Institute è focalizzato sul miglioramento della salute dei bambini, sulla trasformazione della medicina pediatrica e sulla garanzia di un futuro più sano attraverso l’incessante ricerca della conoscenza. Lurie Children’s è un’organizzazione no-profit impegnata a fornire accesso a cure eccezionali a tutti i bambini. È classificato come uno dei migliori ospedali pediatrici del paese da US News & World Report. Lurie Children’s è il centro di formazione pediatrica della Feinberg School of Medicine della Northwestern University.
Riferimento : studio di fase 3 sull’immunoterapia epicutanea nei bambini piccoli con allergia alle arachidi. Giornale di medicina del New England , 2023; 388 (19): 1755 DOI: 10.1056/NEJMoa2212895 Matthew Greenhawt, MD, Sayantani B. Sindher, MD, Julie Wang, MD, Michael O’Sullivan, et al.
(Finanziato da DBV Technologies; numero EPITOPE ClinicalTrials.gov, NCT03211247. si apre in una nuova scheda.)
















