Le lupus érythémateux systémique (LED) est une maladie auto-immune dans laquelle plus de 90 % des patients sont des femmes. Les symptômes varient considérablement, allant de légères manifestations cutanées à une défaillance organique potentiellement mortelle.
Bien que le pronostic depuis l’introduction des corticostéroïdes et d’autres modalités de traitement se soit considérablement amélioré, il existe toujours une mortalité accrue dans le LED avec complications, en particulier dans le cas de néphrite lupique et de maladies cardiovasculaires (MCV).
L’évolution des critères diagnostiques du LED est intéressante en soi, et les plus récents proviennent de la Ligue européenne contre les rhumatismes/American College of Rheumatology en 2019, où des anticorps antinucléaires (ANA) positifs étaient requis comme critère d’entrée, puis une combinaison de critères cliniques. manifestations et mesures sérologiques/immunologiques.
Il convient de noter que les maladies rhumatismales en général reposent sur des critères , ce qui reflète le fait que la connaissance de leurs causes est relativement rare, même si les mécanismes directement responsables sont beaucoup plus définis. Il est probable que ces critères changeront à l’avenir et que les frontières entre ces maladies, notamment les maladies auto-immunes systémiques (TAS), ne seront pas aussi claires que le suggèrent les critères.
La présence d’ANA comme condition préalable au diagnostic illustre que la matière nucléaire (avec des cellules mortes comme origine probable) et l’auto-immunité contre elle sont une caractéristique centrale de la maladie. L’élimination anormale et/ou dysfonctionnelle des cellules mortes représente un autre aspect important. Un déséquilibre du système immunitaire avec une proportion plus faible de cellules T régulatrices (Tregs) est une autre particularité du LED et un exemple d’aberration immunologique.
Le LED est relativement rare. Son incidence augmente dans plusieurs pays mais cela peut être attribué à un meilleur diagnostic. Il existe également des différences intéressantes entre les ethnies, le LED étant plus fréquent chez les populations africaines et arabes, plus faible chez les populations hispaniques et asiatiques, et encore plus faible chez les Caucasiens.
Le pronostic du LED était bien pire avant l’instauration d’un traitement par immunosuppresseurs, notamment la cortisone. Après cela, il est devenu clair que les maladies cardiovasculaires étaient importantes en tant que complication ultérieure et, dans une étude majeure de la fin des années 1970, un schéma bimodal de LED a été rapporté, dans lequel les complications les plus aiguës à un stade précoce de la maladie étaient souvent suivies par des maladies cardiovasculaires à un stade précoce. une étape ultérieure.
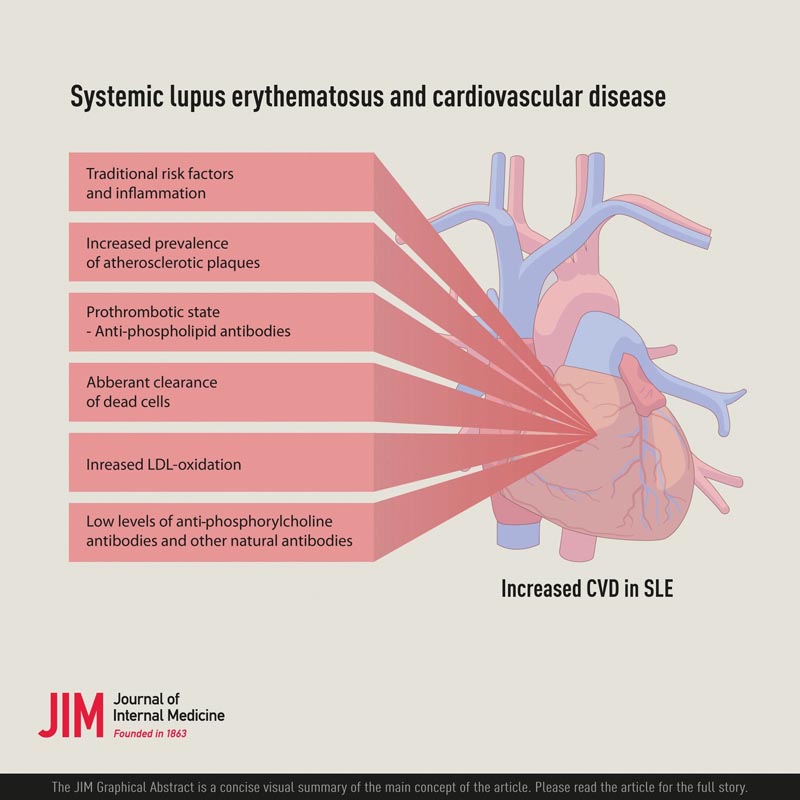
Une question importante, étant donné le risque accru de MCV dans le LED, est de savoir quels sont les facteurs de risque impliqués. Une étude contrôlée a révélé qu’une combinaison de facteurs de risque traditionnels et non traditionnels était impliquée. Parmi les anticoagulants non traditionnels, des taux accrus de lipoprotéines de basse densité oxydées (OxLDL) ainsi que d’anticoagulants lupiques, liés aux anticorps antiphospholipides, ont été observés. Parmi les maladies traditionnelles, la dyslipidémie était associée aux maladies cardiovasculaires. Cependant, la dyslipidémie dans le LED présente des caractéristiques spécifiques, avec de faibles lipoprotéines de haute densité (HDL), des triglycérides élevés, mais pas de LDL élevé.
La cause sous-jacente des maladies cardiovasculaires dans le LED peut être liée à la fois à la thrombose, au syndrome des anticorps antiphospholipides (APS) provoqué par les anticorps antiphospholipides (aPL) et à la maladie athéroscléreuse , qui ne s’excluent pas encore mutuellement.
En général, le SAPL se caractérise par des thromboses, tant artérielles que veineuses, et par des complications de la grossesse, notamment un avortement spontané.
Le SAF est divisé en primaire et secondaire , le premier étant rare, bien que l’aFL en soi puisse être déterminé chez 1 à 5 % de la population, conduisant rarement à un SAF. La détermination de l’aPL est également importante dans d’autres maladies auto-immunes systémiques, pas seulement dans le LED, afin de réduire le risque de SAPL secondaire.
Les anticorps antiphospholipides reconnaissent les phospholipides, en particulier la cardiolipine (CL), et il est devenu clair que les protéines de liaison aux phospholipides jouent un rôle important, la bêta-2-glycoprotéine étant actuellement considérée comme la plus pertinente en tant que cofacteur de l’aPL. Très probablement, les effets pathogènes peuvent être divisés en deux, qui ne s’excluent pas mutuellement : les effets directs sur l’endothélium et d’autres cellules et plaquettes, et l’interférence avec le système de coagulation conduisant à un état prothrombotique.
Les effets sur le système de coagulation pourraient jouer un rôle important dans les maladies cardiovasculaires liées au LED par différents mécanismes. De plus, il existe ici plusieurs possibilités qui ne s’excluent pas mutuellement. Un mécanisme spécifique par lequel l’aPL peut provoquer des maladies cardiovasculaires telles qu’un accident vasculaire cérébral et un infarctus du myocarde dans le LED est lié à l’annexine A5 , une protéine connue pour se lier à la phosphatidylsérine, qui est exposée sur les cellules mortes et mourantes et qui fonctionne comme un modèle moléculaire associé au danger (DAMP ).
Le caractère inflammatoire de l’athérosclérose est connu depuis longtemps. Le LED pourrait favoriser l’athérosclérose et/ou les plaques d’athérosclérose.
Dans le même temps, l’athérosclérose est un processus inflammatoire qui se développe lentement dans les artères. Elle se caractérise par l’accumulation de cellules mortes, d’OxLDL, et d’un infiltrat activé de cellules immunocompétentes, notamment de cellules T, de monocytes/macrophages, ainsi que de cellules musculaires lisses, mais peu de granulocytes, qui sont généralement un composant majeur de l’arthrite comme de la rhumatoïde. arthrite.
Les lymphocytes T et les monocytes/macrophages montrent des signes d’activation et produisent des cytokines, principalement pro-inflammatoires telles que l’interleukine 1, 6 et le TNF-alpha et s’accumulent à proximité des lésions et des parties endommagées des plaques. La calcification est également une caractéristique importante de l’athérosclérose et est très probablement un phénomène lié à une inflammation prolongée. Le type exact d’immunomodulation et l’effet anti-inflammatoire sont donc essentiels dans le traitement des maladies cardiovasculaires dans le but d’améliorer l’inflammation de la plaque dentaire.
Il est intéressant de noter que l’accumulation de cellules mortes dans les plaques d’athérosclérose est une caractéristique de cette maladie, qui pourrait être décrite comme une élimination dysfonctionnelle des cellules mortes. De plus, l’OxLDL est un facteur important dans l’athérosclérose et, comme les cellules mortes, s’accumule dans les plaques et augmente le LED.
Depuis qu’il a été établi que les lymphocytes T sont présents dans les plaques athéroscléreuses et produisent également activement des cytokines principalement pro-inflammatoires, leur rôle fonctionnel dans le développement des maladies cardiovasculaires a été largement étudié et discuté. Bien qu’il reste beaucoup à savoir sur le rôle de l’IL-17 et des cellules Th17 correspondantes ainsi que d’autres sous-ensembles de cellules T proinflammatoires, elles semblent être principalement proathérogènes.
Un déséquilibre du système immunitaire avec une proportion plus faible de cellules T régulatrices (Tregs) est une autre caractéristique du LED et un exemple d’étalonnage immunitaire. Les Tregs sont importants pour la suppression des réactions auto-immunes contre soi-même .
Les cellules T régulatrices (Tregs) peuvent supprimer les effets pro-inflammatoires et possèdent également d’autres propriétés intéressantes qui pourraient améliorer l’athérosclérose, telles que l’inhibition de la formation de cellules spumeuses et l’induction de macrophages anti-inflammatoires.
Une option thérapeutique dans les maladies auto-immunes, en particulier dans le LED, pourrait consister à augmenter la proportion de cellules T régulatrices (Tregs), afin de rétablir l’équilibre avec les cellules T effectrices. Les options incluent des composés activateurs de Treg tels que l’interleukine-2 à faible dose.
La cause sous-jacente de la faible proportion de cellules T régulatrices (Tregs) dans le LED n’est pas claire, mais elle pourrait être liée à l’environnement des cytokines, qui favorise le déclin cellulaire. Il existe également d’autres possibilités intéressantes en relation avec l’athérosclérose et le LED, notamment l’OxLDL et les anticorps dits naturels, notamment les anti-PC et l’annexine A5, la protéine plasmatique.
L’ oxydation restant un dénominateur commun, le terme OxLDL est couramment utilisé. L’OxLDL est sous le feu des projecteurs en tant que responsable de l’athérosclérose depuis au moins la fin des années 1980. Il est absorbé par les macrophages , qui deviennent des cellules spumeuses inertes dans les lésions athéroscléreuses, où elles finissent par mourir et font partie d’un noyau nécrotique. OxLDL favorise la mort cellulaire et possède des propriétés pro-inflammatoires et immunostimulatrices.
Une autre cause non mutuellement exclusive des effets proinflammatoires et de l’activation immunitaire par OxLDL est la phosphorylcholine (PC), qui, dans des études antérieures, aurait joué un rôle dans l’activation immunitaire induite par OxLDL et dans la production de la principale cytokine proinflammatoire IFNgamma. .
Les maladies cardiovasculaires constituent donc une cause considérable de morbidité et de mortalité dans le LED et sont provoquées par une combinaison de facteurs ayant des propriétés prothrombotiques et/ou athérogènes. Les facteurs de risque traditionnels, tels que l’hypertension, l’hyperlipidémie et le diabète, devraient être réduits par des thérapies établies dans le cadre de la prévention générale des maladies cardiovasculaires. Des données positives ont récemment été publiées sur l’utilisation des statines, tant dans l’hyperlipidémie que dans le SAPL dans le LED.
Une autre question importante est le rôle que joue le traitement aux corticostéroïdes dans les maladies cardiovasculaires liées au LED. Il existe des associations entre des doses élevées de corticostéroïdes et les maladies cardiovasculaires dans le LED, mais d’un autre côté, ces patients sont ceux qui présentent les manifestations les plus graves et, encore une fois, il est important d’optimiser le traitement afin que les manifestations les plus aiguës de la maladie soient traité du mieux possible.
L’hydroxychloroquine est la pierre angulaire du traitement du LED et, fait intéressant, elle joue également un rôle dans la prévention des maladies cardiovasculaires . Dans une méta-analyse récente, il a été démontré que l’hydroxychloroquine réduisait le risque d’événements thromboemboliques de 49 %.
Le risque de maladie cardiovasculaire est élevé dans le LES et est dû à la fois à un risque accru de thrombose et à une augmentation de l’athérosclérose, en particulier des plaques d’athérosclérose.
Cela représente un problème clinique important, mais pourrait également faire la lumière sur la nature inflammatoire et immunologique de l’athérosclérose. Une combinaison de facteurs de risque traditionnels et non traditionnels, y compris ceux liés au LED en tant qu’activité de la maladie, semble expliquer ce risque accru. Pour la prévention et le traitement des maladies cardiovasculaires dans le LED, les facteurs de risque traditionnels doivent être pris en compte et les ressources thérapeutiques optimisées.