| 1. Introduction |
Les taux de mortalité maternelle aux États-Unis restent les plus élevés parmi les pays développés et continuent d’augmenter. Les maladies cardiovasculaires constituent la principale étiologie des décès maternels dans les pays développés, représentant plus d’un tiers des décès liés à la grossesse. Le plus important est que bon nombre d’entre elles sont évitables.
La thromboembolie veineuse (TEV), (c’est-à-dire la thrombose veineuse profonde [TVP] et/ou l’embolie pulmonaire [EP]), est l’une des principales étiologies cardiovasculaires de morbidité et de mortalité maternelles, représentant 9 % des décès associés. avec la grossesse. À ce stade, la TEV peut avoir de graves conséquences à court terme ainsi que des complications futures telles que le syndrome post-thrombotique.
Dans cette revue, nous visons à fournir un aperçu de l’épidémiologie, des mécanismes, des facteurs de risque, de la présentation et du traitement de la TEV pendant la grossesse et la période post-partum. Certaines stratégies préventives potentielles sont également mises en évidence. Un autre objectif de cette revue est d’explorer les lacunes dans les connaissances dans le domaine et de fournir des orientations pour les recherches futures.
2. Epidémiologie des TEV pendant la grossesse et pendant la période post-partum
Le risque de TEV chez les femmes enceintes et en post-partum est 6 fois plus élevé que chez les femmes non enceintes. Le risque augmente également avec l’âge gestationnel, étant environ 2 fois plus élevé au cours des premier et deuxième trimestres et allant jusqu’à 9 fois au cours du troisième trimestre, alors qu’il est encore plus élevé pendant la période post-partum.
Une analyse de la base de données National Inpatient Sample (NIS) (une base de données administrative américaine) qui comprend plus de 50 millions d’hospitalisations pendant la grossesse et le post-partum entre 1998 et 2009, a montré que les taux d’EP ont augmenté d’environ 72 % lors des admissions pour accouchement et de 169 % pendant le post-partum. hospitalisations. Cette augmentation n’a pas été uniquement attribuée à l’incidence accrue de l’EP, mais également à l’utilisation plus répandue de l’angiographie-pulmonaire par tomodensitométrie (CTPA) chez les femmes enceintes et en post-partum.
En revanche, une étude récente du NIS portant sur plus de 37 millions d’hospitalisations liées à la grossesse et au post-partum entre 2007 et 2015 a montré que les taux d’EP aiguë pour 100 000 hospitalisations liées à la grossesse n’ont pas changé de manière significative au cours de la période d’étude (18,0 pour 100 000 en 2007 contre 19,4 pour 100 000 hospitalisations liées à la grossesse). 100 000 en 2015).
3. Pathogenèse de la TEV pendant la grossesse et la période post-partum
La grossesse et la période post-partum sont considérées comme un état prothrombotique. Cette thrombogénicité accrue est secondaire à des changements physiologiques et sert de mécanisme de protection évolutif contre les saignements pendant l’accouchement. Il existe une activation de la cascade de la coagulation, notamment une production accrue de facteurs de coagulation, une diminution de la disponibilité de la protéine S libre et une diminution des facteurs fibrinolytiques, entraînant un état d’hypercoagulabilité.
Outre les changements hormonaux, il existe d’autres mécanismes qui jouent un rôle dans l’augmentation du risque d’événements thrombotiques pendant la grossesse et la période post-partum. Ceux-ci incluent une accumulation veineuse accrue avec une stase qui en résulte, ainsi qu’une obstruction mécanique par l’utérus qui pourrait provoquer une compression anatomique de la veine iliaque gauche. Il existe également des changements immunologiques, avec une augmentation des cytokines et un dysfonctionnement endothélial vasculaire qui peuvent prédisposer à la TEV ( Figure 1 ).
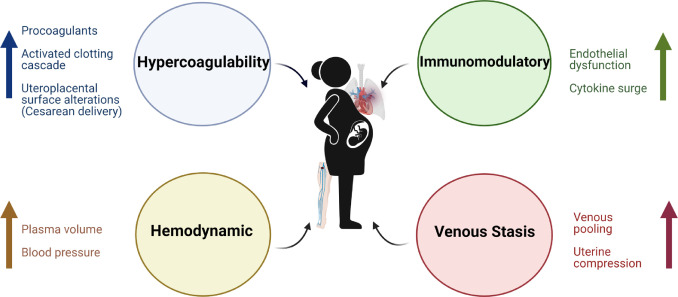
Figure 1. Physiopathologie de la thromboembolie veineuse pendant la grossesse. Les principaux mécanismes physiopathologiques comprennent les modifications immunomodulatrices, l’hypercoagulabilité, les modifications hémodynamiques et la stase veineuse.
4. Facteurs de risque
Outre les mécanismes uniques liés à la grossesse qui prédisposent à la TEV, les facteurs de risque pourraient être largement classés en facteurs de risque préexistants et facteurs de risque spécifiques à la grossesse.
4.1.Facteurs de risque préexistants
Il existe un certain nombre de facteurs de risque préexistants qui augmentent indépendamment le risque de TEV, notamment l’âge avancé, l’obésité, les antécédents de TEV, la thrombophilie, l’immobilisation, les voyages récents, le cancer actif et le tabagisme.
4.2.Facteurs de risque spécifiques à la grossesse
4.2.1. Accouchement par césarienne
L’accouchement par césarienne est associé à un risque accru de TEV par rapport à l’accouchement vaginal. Elle est également associée à un risque accru d’EP par rapport à la TVP. Par rapport à l’accouchement chirurgical planifié, l’accouchement en urgence présente un risque plus élevé de TEV.
L’accouchement par césarienne est associé à l’activation de la cascade de coagulation, ainsi qu’à des altérations de la surface utéroplacentaire qui augmentent le risque de thrombogénicité.
4.2.2.Fécondation in vitro
Les grossesses par fécondation in vitro (FIV) sont associées à un risque accru de TEV par rapport aux grossesses normales. Les grossesses multiples par FIV étaient associées à des taux de TEV plus élevés que les grossesses par FIV uniques.
La pathogenèse sous-jacente de la TEV dans le cadre d’une grossesse par FIV a été liée à la poussée d’œstrogènes. Pendant la FIV, la stimulation ovarienne contrôlée conduit à l’apparition de multiples ovocytes et de niveaux supraphysiologiques d’œstrogènes, entraînant un état procoagulant qui augmente le risque de TEV.
4.2.3.Prééclampsie
La prééclampsie est associée à un risque accru de TEV dans la période post-partum. Bien que les mécanismes à l’origine de ce risque accru de thrombose n’aient pas encore été entièrement élucidés, la prééclampsie est liée à une expression altérée de facteurs antiangiogéniques placentaires qui induisent un dysfonctionnement endothélial, entraînant une protéinurie et une hypertension.
4.2.4.Infections
Les infections sont un autre déclencheur reconnu de TEV pendant la grossesse et la période post-partum. Il y a activation de la cascade de la coagulation avec activation et agrégation plaquettaires, augmentation du stress oxydatif et détérioration de la fonction endothéliale, ce qui augmente à terme le risque de thrombose.
5. Présentation clinique et diagnostic
Les symptômes et les signes de TEV sont souvent non spécifiques et peuvent se chevaucher avec les changements physiologiques de la grossesse, notamment la dyspnée, l’œdème des membres inférieurs et la tachycardie. Il existe donc un risque de diagnostic erroné de TEV pendant la grossesse et la période post-partum.
Le diagnostic de TVP symptomatique est établi par échographie duplex (DUS) des membres inférieurs, qui est largement disponible et ne comporte pas de risque de radiothérapie pour le fœtus. La découverte d’une TVP lors de l’examen DHS établit non seulement le diagnostic de TVP, mais évite également la nécessité d’une imagerie thoracique supplémentaire en cas de suspicion clinique d’EP, car le traitement initial serait le même. Cependant, si une EP est cliniquement suspectée et que l’examen DHS ne documente pas une TVP, des tests de diagnostic supplémentaires sont nécessaires pour évaluer l’EP par imagerie thoracique utilisant CTPA et/ou scintigraphie de perfusion pulmonaire (scan V/Q). ( Figure 2 ).
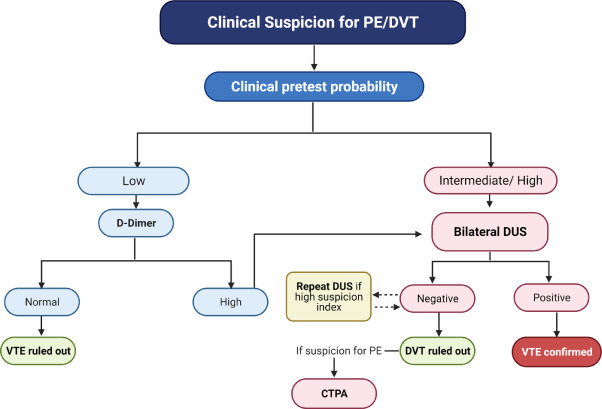
Figure 2. Étude diagnostique en cas de suspicion de thromboembolie veineuse aiguë au cours de la grossesse. Algorithme qui pourrait être adopté pendant la grossesse et la période post-partum lorsqu’il existe des signes et symptômes faisant suspecter une TEV, tels qu’un gonflement unilatéral des extrémités, une dyspnée et/ou une hypoxie. TEV : thromboembolie veineuse ; TVP : thrombose veineuse profonde ; PE : embolie pulmonaire ; DHS : écho-Doppler des membres inférieurs ; CTPA : angiographie pulmonaire par tomodensitométrie.
La MP se manifeste le plus souvent par une dyspnée. Il est important de noter que les deux tiers des femmes enceintes et en post-partum ont une saturation en oxygène normale au moment de la présentation et que, par conséquent, l’absence d’hypoxie ne doit pas exclure le diagnostic. En général, la CTPA et la numérisation V/Q sont deux modalités couramment utilisées pour la détection/exclusion de l’EP chez les femmes enceintes. Bien qu’il n’y ait pas eu de comparaison directe entre la numérisation CTPA et V/Q, les deux présentent leurs avantages et leurs inconvénients.
L’émergence de techniques d’imagerie modernes plus sophistiquées a encore réduit l’exposition maternelle et fœtale aux rayonnements et donc le risque qui y est associé. L’IRM thoracique est une autre modalité qui peut être utilisée dans l’arsenal diagnostique de la MP, et qui présente l’avantage de ne pas irradier ; cependant, la disponibilité limitée et les données inconnues sur la sécurité maternelle et fœtale chez l’homme constituent des limites importantes.
6. Prise en charge de la TEV pendant la grossesse et après l’accouchement
Le traitement principal de la TEV aiguë pendant la grossesse et pendant la période post-partum est l’anticoagulation. L’anticoagulant de choix est l’héparine, de préférence l’héparine de bas poids moléculaire (HBPM), bien que l’héparine non fractionnée (HNF) puisse également être utilisée, puisque les deux agents ne traversent pas la barrière placentaire. Cela contraste avec les dérivés de la coumarine, tels que la warfarine, qui traversent la barrière placentaire et peuvent potentiellement provoquer une tératogénicité, des fausses couches, des saignements fœtaux et des déficiences neurodéveloppementales.
Avec la progression de la grossesse, un ajustement posologique peut être nécessaire en fonction des changements de poids maternel pour garantir une anticoagulation adéquate. Bien que les femmes enceintes recevant une HBPM présentent souvent des taux minimaux d’anti-Xa sous-thérapeutiques et nécessitent des doses plus élevées pour atteindre les niveaux cibles, la surveillance systématique des taux d’anti-Xa n’est pas recommandée étant donné le profil prévisible des HBPM.
À l’approche de l’accouchement, une administration biquotidienne d’HBPM ou, de préférence, un passage à l’HNF peuvent être envisagés compte tenu de la demi-vie plus courte, réduisant le risque d’hémorragie maternelle et garantissant l’accès à l’analgésie et à l’anesthésie neuraxiale. Bien qu’aucune étude n’ait évalué la durée optimale du traitement anticoagulant pour le traitement de la TEV liée à la grossesse, un traitement anticoagulant est recommandé pour le reste de la période gestationnelle et pendant au moins 6 semaines après l’accouchement et jusqu’à au moins 3 mois de traitement au total.
6.1.Prise en charge de la TVP
Bien que le traitement principal de la TVP aiguë soit l’anticoagulation, le rôle de la thrombolyse dirigée par cathéter, qui est une technique mini-invasive pour le traitement de la TVP iliofémorale aiguë, n’est pas bien établi chez les femmes enceintes. La principale préoccupation lors de la réalisation d’une thrombolyse dirigée par cathéter est l’exposition fœtale aux radiations, en particulier au cours du premier trimestre en raison de la dose élevée utilisée.
Cependant, au cours des deuxième et troisième trimestres, des précautions appropriées, notamment des techniques de protection et de réduction de dose, pourraient rendre cette procédure plus sûre. En cas d’obstruction sévère de l’écoulement veineux après thrombolyse, la pose d’un stent dans la veine iliaque pourrait être retardée jusqu’après l’accouchement, si possible.
6.2.Gestion du PE
La prise en charge de l’EP aiguë pendant la grossesse implique une stratification initiale du risque et une évaluation clinique, y compris l’état hémodynamique et la taille et la fonction du ventricule droit, ainsi que l’imagerie, des études de biomarqueurs et l’utilisation de systèmes de notation validés pour stratifier la gravité. La prise de décision partagée au sein d’une équipe multidisciplinaire d’obstétrique, de cardiologie, de pneumologie, d’hématologie, de médecine vasculaire, d’anesthésiologie/soins intensifs, de chirurgie cardiothoracique et de radiologie interventionnelle est importante.
Pour l’EP aiguë à faible risque, définie comme hémodynamiquement stable avec une fonction ventriculaire droite normale et l’absence de lésion des organes cibles, le choix préférable est l’HBPM, tandis que l’autre option est l’HNF. Ces patients peuvent être pris en charge en ambulatoire et ne nécessitent pas d’hospitalisation. L’EP aiguë à haut risque, caractérisée par une instabilité hémodynamique avec hypoperfusion des organes cibles, est rare pendant la grossesse mais met la vie en danger et nécessite une hospitalisation. ( Figure 3 ).
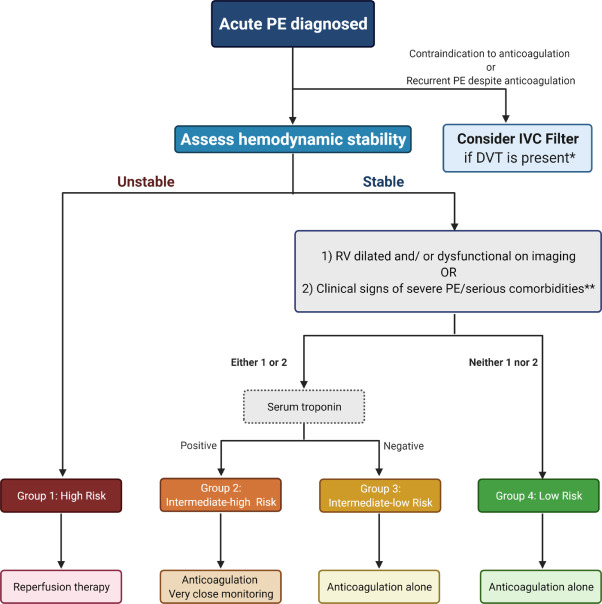
Figure 3. Prise en charge de l’embolie pulmonaire aiguë pendant la grossesse. Démontre le schéma de stratification précoce du risque et de gestion de l’embolie pulmonaire aiguë. PE : embolie pulmonaire ; Filtre IVC : filtre de la veine cave inférieure. *Le filtre VCI pourrait être envisagé chez les femmes présentant une embolie pulmonaire sans signe de TVP et qui ne sont pas candidates à une anticoagulation systémique. * * Antécédents de tumeur maligne, d’insuffisance cardiaque congestive, de maladie pulmonaire interstitielle chronique ou obstructive.
Pour les femmes enceintes présentant une contre-indication absolue au traitement anticoagulant ou présentant une EP récurrente malgré une anticoagulation adéquate, des filtres de veine cave inférieure (VCI) pourraient être envisagés dans le but d’empêcher des caillots veineux supplémentaires d’atteindre la circulation pulmonaire. .
7. Récidive et prévention des TEV pendant la grossesse et après l’accouchement
Les patientes atteintes de TEV associée à la grossesse ont un risque de récidive allant jusqu’à 13 % au cours des grossesses ultérieures. Certaines données suggèrent que la thromboprophylaxie est associée à une réduction du risque de récidive de TEV.
Bien que le traitement médicamenteux puisse réduire l’incidence et la récidive des TEV pendant la grossesse et la période post-partum, la thromboprophylaxie universelle peut ne pas constituer une approche sûre, en raison du risque d’hémorragie maternelle, ainsi que du risque de thrombocytopénie induite par l’héparine et de fractures ostéoporotiques associées à héparinisation. Par conséquent, la thromboprophylaxie systématique n’est recommandée que pour les femmes considérées comme présentant un risque élevé de TEV en fonction de certains facteurs, tels qu’un antécédent de TEV associée aux œstrogènes ou une thrombophilie héréditaire.
Il n’y a pas eu d’études comparatives comparant les HBPM aux HNF chez les femmes enceintes, et les données sur la prophylaxie proviennent de la population non enceinte. Les HBPM sont généralement administrées pendant la grossesse à différentes doses (prophylactiques, intermédiaires, thérapeutiques), et il manque un consensus fondé sur des données probantes concernant la stratégie posologique optimale.
La thromboprophylaxie pharmacologique est généralement réservée à une population sélectionnée de femmes enceintes considérées comme présentant un risque élevé de TEV. Des antécédents de TEV unique idiopathique, associée à la grossesse ou aux œstrogènes sont associés à un risque 10 fois plus élevé et à un risque absolu > 1 % de TEV. Les données suggèrent que les femmes ayant déjà eu une TEV liée à la grossesse ou associée à un contraceptif oral sont plus susceptibles d’avoir une TEV récurrente pendant la grossesse que celles ayant déjà eu une TEV non provoquée ou non associée aux hormones.
Les recommandations en matière de thromboprophylaxie pharmacologique dans des troubles thrombophiliques spécifiques sont sujettes à des variations selon les différentes lignes directrices. Chez les patientes atteintes de thrombophilie héréditaire, la candidature à une thromboprophylaxie est déterminée par le type de thrombophilie héréditaire, les antécédents familiaux de TEV et la période antepartum versus postpartum.
Pour les femmes atteintes du syndrome des anticorps antiphospholipides et ayant des antécédents de trois avortements manqués ou plus, l’administration antepartum d’héparine non fractionnée prophylactique ou à dose intermédiaire ou d’héparine prophylactique de bas poids moléculaire associée à de l’aspirine à faible dose (75-100 mg) est recommandée. / jour).
L’accouchement par césarienne d’urgence est lui-même admissible à la prophylaxie post-partum dans certaines lignes directrices, tandis que d’autres suggèrent une prophylaxie pharmacologique après une césarienne uniquement s’il existe des facteurs de risque supplémentaires (tels que l’obésité, l’âge avancé, une tumeur maligne sous-jacente, une immobilisation prolongée). Une déambulation précoce et/ou des dispositifs mécaniques (par exemple, compression pneumatique intermittente) sont suggérés chez les patientes qui subissent un accouchement par césarienne et qui ne présentent aucun facteur de risque supplémentaire de TEV.
8. Orientations futures
La TEV est une situation de mortalité maternelle potentiellement évitable. La morbidité et la mortalité associées à la TEV restent alarmantes et nécessitent des efforts futurs pour combler les lacunes qui existent dans nos connaissances et notre compréhension des mécanismes, des facteurs de risque et de la prise en charge.
Premièrement, les scores de prédiction de la TEV existants sont basés sur des critères qui excluent les femmes enceintes et sont justifiés par des caractéristiques rarement appliquées aux femmes enceintes, comme l’âge avancé ou le cancer. Par conséquent, des études visant à développer des scores de risque et des modèles prédictifs pouvant être applicables aux femmes enceintes et en post-partum sont nécessaires. Il est également nécessaire de développer des programmes éducatifs pour doter les prestataires de soins de santé des connaissances nécessaires pour identifier, gérer et prévenir la TEV chez les femmes enceintes.
Deuxièmement, les recommandations actuelles en matière de thromboprophylaxie pendant la grossesse et après l’accouchement sont stratifiées en fonction des antécédents thrombotiques ou de la thrombophilie sous-jacente. Il existe d’autres facteurs de risque importants (par exemple, l’âge, la race, l’IMC, les infections et les complications de la grossesse) qui devraient être pris en compte dans le processus décisionnel concernant la prévention de la TEV liée à la grossesse.
Troisièmement, d’autres études sont recommandées pour valider les algorithmes de diagnostic de la TEV pendant la grossesse, en utilisant les techniques d’imagerie radiologique actuelles et de faibles doses de rayonnement.
Enfin, des travaux à grande échelle sont nécessaires pour évaluer l’efficacité et la sécurité des options thérapeutiques avancées pour la TEV à haut risque ; cependant, de telles études peuvent être difficiles étant donné la rareté de cette pathologie. Combler ces lacunes dans les connaissances aidera les cliniciens à mieux comprendre la maladie et contribuera à améliorer les résultats pour les patients.
9. Conclusions La TEV est l’une des principales étiologies de morbidité et de mortalité maternelles et est potentiellement évitable. Il existe des mécanismes liés à la grossesse qui présentent un risque accru de TEV chez les femmes enceintes par rapport à leurs homologues non enceintes, en particulier pendant la période post-partum. Le CTPA est la modalité de diagnostic privilégiée en cas de suspicion d’EP, en particulier avec les techniques modernes à faible dose qui réduisent davantage l’exposition aux rayonnements. Alors que le traitement de la TVP repose principalement sur l’anticoagulation, le traitement de l’EP dépend de l’algorithme de stratification du risque, allant de l’anticoagulation chez les patients à faible risque aux thérapies avancées chez les patients atteints d’EP à haut risque. Il existe certaines indications de thromboprophylaxie. Des études futures sont nécessaires pour combler certaines lacunes dans les connaissances sur ce sujet pertinent. |
















